Почему аминокислоты получили такое название. Оптимальное соотношение BCAA. Значение аминокислот в бодибилдинге
Органические (карбоновые) кислоты, содержащие, как правило, одну или две аминогруппы (NH2). В зависимости от положения аминогруппы в углеродной цепи по отношению к карбоксилу различают а, b , y и т. д. А. в природе широко распространены a А.,… … Биологический энциклопедический словарь
АМИНОКИСЛОТЫ, класс органических соединений, содержащих карбоксильные (COOH) и аминогруппы (NH2); обладают свойствами и кислот, и оснований. Участвуют в обмене азотистых веществ всех организмов (исходные соединения при биосинтезе гормонов,… … Современная энциклопедия
Класс органических соединений, содержащих карбоксильные (COOH) и аминогруппы (NH2); обладают свойствами и кислот, и оснований. Участвуют в обмене азотистых веществ всех организмов (исходное соединение при биосинтезе гормонов, витаминов,… … Большой Энциклопедический словарь
АМИНОКИСЛОТЫ, от, ед. аминокислота, ы, жен. (спец.). Класс органических соединений, обладающих свойствами и кислот, и оснований. | прил. аминокислотный, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
Орг. соединения с двойной функцией кислотной, обусловленной присутствием карбоксильной группы (см. Карбоксил), и основной, связанной с наличием аминогруппы (NH2) или (реже) иминогруппы (NH), входящей обычно в состав гетероцикла. Примеры … Геологическая энциклопедия
аминокислоты - органические соединения, содержащие одну или две аминогруппы; производные карбоновых кислот, у которых в радикале водород замещен на аминогруппу; структурные единицы белковой молекулы. белковые: аланин. аргинин. аспарагин. пролин. аспарагиновая… … Идеографический словарь русского языка
аминокислоты - – карбоновые кислоты, у которых, как минимум, один атом углерода углеводородной цепи замещен на аминогруппу … Краткий словарь биохимических терминов
АМИНОКИСЛОТЫ - АМИНОКИСЛОТЫ, органические кислоты (содержащие группу СООН), в к рых один или несколько атомов Н в алкогольном радикале замещены щелочными амино группа ми (NHa), вследствие чего А. принадлежат к г. н. амфотерным соединениям. В зависимо сти от… … Большая медицинская энциклопедия
Аминокислоты - * амінакіслоты * amino acids класс органических соединений, для которых характерны свойства как карбоновых кислот, так и аминов (табл.). Они различаются между собой по химической природе боковых цепей (групп). На основе полярности групп А. могут … Генетика. Энциклопедический словарь
АМИНОКИСЛОТЫ - класс органических соединений, молекулы которых содержат аминогруппы (NH2) и карбоксильные группы (СООН). А. широко распространены в природе, входят в состав белковых молекул. Все А. твёрдые кристаллические вещества, хорошо растворяются в воде… … Большая политехническая энциклопедия
Аминокислоты, белки и пептиды являются примерами соединений, описанных далее. Многие биологически активные молекулы включают несколько химически различных функциональных групп, которые могут взаимодействовать между собой и с функциональными группа друг друга.
Аминокислоты.
Аминокислоты - органические бифункциональные соединения, в состав которых входит карбоксильная группа -СООН , а аминогруппа - NH 2 .
Разделяют α и β - аминокислоты:
В природе встречаются в основном α -кислоты. В состав белков входят 19 аминокислот и ода иминокислота (С 5 Н 9 NO 2 ):


Самая простая аминокислота - глицин. Остальные аминокислоты можно разделить на следующие основные группы:
1) гомологи глицина - аланин, валин, лейцин, изолейцин.
Получение аминокислот.
Химические свойства аминокислот.
Аминокислоты - это амфотерные соединения, т.к. содержат в своём составе 2 противоположные функциональные группы - аминогруппу и гидроксильную группу. Поэтому реагируют и с кислотами и с щелочами:
Кислотно-основные превращение можно представить в виде:
Белки составляют материальную основу химической деятельности клетки. Функции белков в природе универсальны. Названию белки, наиболее принятому в отечественной литературе, соответствует термин протеины (от греч. proteios - первый). К настоящему времени достигнуты большие успехи в установлении соотношения структуры и функций белков, механизма их участия в важнейших процессах жизнедеятельности организма и в понимании молекулярных основ патогенеза многих болезней.
В зависимости от молекулярной массы различают пептиды и белки. Пептиды имеют меньшую молекулярную массу, чем белки. Для пептидов более свойственна регуляторная функция (гормоны, ингибиторы и активаторы ферментов, переносчики ионов через мембраны, антибиотики, токсины и др.).
12.1. α -Аминокислоты
12.1.1. Классификация
Пептиды и белки построены из остатков α-аминокислот. Общее число встречающихся в природе аминокислот превышает 100, но некоторые из них обнаружены лишь в определенном сообществе орга- низмов, 20 наиболее важных α-аминокислот постоянно встречаются во всех белках (схема 12.1).
α-Аминокислоты - гетерофункциональные соединения, молекулы которых содержат одновременно аминогруппу и карбоксильную группу у одного и того же атома углерода.
Схема 12.1. Важнейшие α-аминокислоты*

* Сокращенные обозначения применяются только для записи аминокислотных остатков в молекулах пептидов и белков. ** Незаменимые аминокислоты.
Названия α-аминокислот могут быть построены по заместительной номенклатуре, но чаще используются их тривиальные названия.

Тривиальные названия α-аминокислот обычно связаны с источниками выделения. Серин входит в состав фиброина шелка (от лат. serieus - шелковистый); тирозин впервые выделен из сыра (от греч. tyros - сыр); глутамин - из злаковой клейковины (от нем. Gluten - клей); аспарагиновая кислота - из ростков спаржи (от лат. asparagus - спаржа).
Многие α-аминокислоты синтезируются в организме. Некоторые аминокислоты, необходимые для синтеза белков, в организме не образуются и должны поступать извне. Такие аминокислоты называют незаменимыми (см. схему 12.1).
К незаменимым α-аминокислотам относятся:
валин изолейцин метионин триптофан
лейцин лизин треонин фенилаланин
α-Аминокислоты классифицируют несколькими способами в зависимости от признака, положенного в основу их деления на группы.
Одним из классификационных признаков служит химическая природа радикала R. По этому признаку аминокислоты делятся на алифатические, ароматические и гетероциклические (см. схему 12.1).
Алифатические α-аминокислоты. Это наиболее многочисленная группа. Внутри нее аминокислоты подразделяют с привлечением дополнительных классификационных признаков.
В зависимости от числа карбоксильных групп и аминогрупп в молекуле выделяют:
Нейтральные аминокислоты - по одной группе NH 2 и СООН;
Основные аминокислоты - две группы NH 2 и одна группа
СООН;
Кислые аминокислоты - одна группа NH 2 и две группы СООН.
Можно отметить, что в группе алифатических нейтральных аминокислот число атомов углерода в цепи не бывает больше шести. При этом не существует аминокислоты с четырьмя атомами углерода в цепи, а аминокисоты с пятью и шестью атомами углерода имеют только разветвленное строение (валин, лейцин, изолейцин).
В алифатическом радикале могут содержаться «дополнительные» функциональные группы:
Гидроксильная - серин, треонин;
Карбоксильная - аспарагиновая и глутаминовая кислоты;
Тиольная - цистеин;
Амидная - аспарагин, глутамин.
Ароматические α-аминокислоты. К этой группе относятся фенилаланин и тирозин, построенные таким образом, что бензольные кольца в них отделены от общего α-аминокислотного фрагмента метиленовой группой -СН 2-.

Гетероциклические α-аминокислоты. Относящиеся к этой группе гистидин и триптофан содержат гетероциклы - имидазол и индол соответственно. Строение и свойства этих гетероциклов рассмотрены ниже (см. 13.3.1; 13.3.2). Общий принцип построения гетероциклических аминокислот такой же, как и ароматических.
Гетероциклические и ароматические α-аминокислоты можно рассматривать как β-замещенные производные аланина.

К героциклическим относится также аминокислота пролин, в которой вторичная аминогруппа включена в состав пирролидинового

В химии α-аминокислот большое внимание уделяется строению и свойствам «боковых» радикалов R, которые играют важную роль в формировании структуры белков и выполнении ими биологических функций. Большое значение имеют такие характеристики, как полярность «боковых» радикалов, наличие в радикалах функциональных групп и способность этих функциональных групп к ионизации.
В зависимости от бокового радикала выделяют аминокислоты с неполярными (гидрофобными) радикалами и аминокислоты c поляр- ными (гидрофильными) радикалами.
К первой группе относятся аминокислоты с алифатическими боковыми радикалами - аланин, валин, лейцин, изолейцин, метионин - и ароматическими боковыми радикалами - фенилаланин, триптофан.
Ко второй группе принадлежат аминокислоты, у которых в радикале имеются полярные функциональные группы, способные к иони- зации (ионогенные) или не способные переходить в ионное состояние (неионогенные) в условиях организма. Например, в тирозине гидроксильная группа ионогенная (имеет фенольный характер), в серине - неионогенная (имеет спиртовую природу).

Полярные аминокислоты с ионогенными группами в радикалах в определенных условиях могут находиться в ионном (анионном или катионном) состоянии.

12.1.2. Стереоизомерия
Основной тип построения α-аминокислот, т. е. связь одного и того же атома углерода с двумя разными функциональными группами, радикалом и атомом водорода, уже сам по себе предопределяет хираль- ность α-атома углерода. Исключение составляет простейшая аминокислота глицин H 2 NCH 2 COOH, не имеющая центра хиральности.
Конфигурация α-аминокислот определяется по конфигурационному стандарту - глицериновому альдегиду. Расположение в стандартной проекционной формуле Фишера аминогруппы слева (подобно группе ОН в l-глицериновом альдегиде) соответствует l-конфи- гурации, справа - d-конфигурации хирального атома углерода. По R, S-системе α-атом углерода у всех α-аминокислот l-ряда имеет S-, а у d-ряда - R-конфигурацию (исключение составляет цистеин, см. 7.1.2).
Большинство α-аминокислот содержит в молекуле один асимметрический атом углерода и существует в виде двух оптически активных энантиомеров и одного оптически неактивного рацемата. Почти все природные α-аминокислоты принадлежат к l-ряду.

Аминокислоты изолейцин, треонин и 4-гидроксипролин содержат в молекуле по два центра хиральности.

Такие аминокислоты могут существовать в виде четырех стереоизомеров, представляющих собой две пары энантиомеров, каждая из которых образует рацемат. Для построения белков животных организмов используется только один из энантиомеров.
Стереоизомерия изолейцина аналогична рассмотренной ранее стереоизомерии треонина (см. 7.1.3). Из четырех стереоизомеров в состав белков входит l-изолейцин с S-конфигурацией обоих асимметрических атомов углерода С-α и С-β. В названиях другой пары энантиомеров, являющихся диастереомерами по отношению к лейцину, используется приставка алло-.

Расщепление рацематов. Источником получения α-аминокислот l-ряда служат белки, которые подвергают для этого гидролитическому расщеплению. В связи с большой потребностью в отдельных энантиомерах (для синтеза белков, лекарственных веществ и т. п.) разработаны химические методы расщепления синтетических рацемических аминокислот. Предпочтителен ферментативный способ расщепления с использованием ферментов. В настоящее время для разделения рацемических смесей используют хроматографию на хиральных сорбентах.
12.1.3. Кислотно-основные свойства
Амфотерность аминокислот обусловлена кислотными (СООН) и основными (NH 2) функциональными группами в их молекулах. Аминокислоты образуют соли как со щелочами, так и с кислотами.
В кристаллическом состоянии α-аминокислоты существуют как диполярные ионы H3N+ - CHR-COO- (обычно используемая запись
строения аминокислоты в неионизированной форме служит лишь для удобства).
В водном растворе аминокислоты существуют в виде равновесной смеси диполярного иона, катионной и анионной форм.

Положение равновесия зависит от рН среды. У всех аминокислот преобладают катионные формы в сильнокислых (рН 1-2) и анион- ные - в сильнощелочных (рН >11) средах.
Ионное строение обусловливает ряд специфических свойств аминокислот: высокую температуру плавления (выше 200 ?С), растворимость в воде и нерастворимость в неполярных органических растворителях. Способность большинства аминокислот хорошо растворяться в воде является важным фактором обеспечения их биологического функционирования, с нею связаны всасывание аминокислот, их транспорт в организме и т. п.
Полностью протонированная аминокислота (катионная форма) с позиций теории Брёнстеда является двухосновной кислотой,
Отдавая один протон, такая двухосновная кислота превращается в слабую одноосновную кислоту - диполярный ион с одной кислотной группой NH 3 + . Депротонирование диполярного иона приводит к получению анионной формы аминокислоты - карбоксилат-иона, являющегося основанием Брёнстеда. Значения характеризую-
щие кислотные свойства карбоксильной группы аминокислот, обычно лежат в интервале от 1 до 3; значения рK а2 характеризующие кислотность аммониевой группы, - от 9 до 10 (табл. 12.1).
Таблица 12.1. Кислотно-основные свойства важнейших α-аминокислот

Положение равновесия, т. е. соотношение различных форм аминокислоты, в водном растворе при определенных значениях рН существенно зависит от строения радикала, главным образом от присутствия в нем ионогенных групп, играющих роль дополнительных кислотных и основных центров.
Значение рН, при котором концентрация диполярных ионов максимальна, а минимальные концентрации катионных и анионных форм аминокислоты равны, называется изоэлектрической точкой (p/).
Нейтральные α-аминокислоты. Эти аминокислоты имеют значения рI несколько ниже 7 (5,5-6,3) вследствие большей способности к ионизации карбоксильной группы под влиянием -/-эффекта группы NH 2 . Например, у аланина изоэлектрическая точка находится при рН 6,0.

Кислые α-аминокислоты. Эти аминокислоты имеют в радикале дополнительную карбоксильную группу и в сильнокислой среде находятся в полностью протонированной форме. Кислые аминокислоты являются трехосновными (по Брёндстеду) с тремя значениями рК а, как это видно на примере аспарагиновой кислоты (р/ 3,0).

У кислых аминокислот (аспарагиновой и глутаминовой) изоэлектрическая точка находится при рН много ниже 7 (см. табл. 12.1). В организме при физиологических значениях рН (например, рН крови 7,3-7,5) эти кислоты находятся в анионной форме, так как у них ионизированы обе карбоксильные группы.
Основные α-аминокислоты. В случае основных аминокислот изоэлектрические точки находятся в области рН выше 7. В сильно- кислой среде эти соединения также представляют собой трехосновные кислоты, этапы ионизации которых показаны на примере лизина (р/ 9,8).

В организме основные аминокислоты находятся в виде катионов, т. е. у них протонированы обе аминогруппы.
В целом ни одна α -аминокислота in vivo не находится в своей изоэлектрической точке и не попадает в состояние, отвечающее наименьшей растворимости в воде. Все аминокислоты в организме находятся в ионной форме.
12.1.4. Аналитически важные реакции α -аминокислот
α-Аминокислоты как гетерофункциональные соединения вступают в реакции, характерные как для карбоксильной, так и для аминогруппы. Некоторые химические свойства аминокислот обусловлены функциональными группами в радикале. В настоящем разделе рассматриваются реакции, имеющие практическое значение для идентификации и анализа аминокислот.
Этерификация. При взаимодействии аминокислот со спиртами в присутствии кислотного катализатора (например, газообразный хлороводород) с хорошим выходом получаются сложные эфиры в виде гидрохлоридов. Для выделения свободных эфиров реакционную смесь обрабатывают газообразным аммиаком.

Сложные эфиры аминокислот не имеют диполярного строения, поэтому, в отличие от исходных кислот, они растворяются в органических растворителях и обладают летучестью. Так, глицин - крис- таллическое вещество с высокой температурой плавления (292 ?С), а его метиловый эфир - жидкость с температурой кипения 130 ?С. Анализ эфиров аминокислот можно проводить с помощью газожидкостной хроматографии.
Реакция с формальдегидом. Практическое значение имеет реакция с формальдегидом, которая лежит в основе количественного определения аминокислот методом формольного титрования (метод Сёренсена).
Амфотерность аминокислот не позволяет проводить непосредственно титрование их щелочью в аналитических целях. При взаимодействии аминокислот с формальдегидом получаются относительно устойчивые аминоспирты (см. 5.3) - N-гидроксиметильные производные, свободную карбоксильную группу которых затем титруют щелочью.
Качественные реакции. Особенность химии аминокислот и белков заключается в использовании многочисленных качественных (цветных) реакций, составлявших ранее основу химического анализа. В настоящее время, когда исследования проводятся с помощью физико-химических методов, многие качественные реакции продолжают применять для обнаружения α-аминокислот, например, в хроматографическом анализе.
Хелатообразование. С катионами тяжелых металлов α-аминокислоты как бифункциональные соединения образуют внутрикомплексные соли, например, со свежеприготовленным гидроксидом меди(11) в мягких условиях получаются хорошо кристаллизующиеся хелатные
соли меди(11) синего цвета (один из неспецифических способов обнаружения α-аминокислот).

Нингидринная реакция. Общая качественная реакция α-аминокислот - реакция с нингидрином. Продукт реакции имеет синефиолетовый цвет, что используется для визуального обнаружения аминокислот на хроматограммах (на бумаге, в тонком слое), а также для спектрофотометрического определения на аминокислотных анализаторах (продукт поглощает свет в области 550-570 нм).

Дезаминирование. В лабораторных условиях эта реакция осуществляется при действии азотистой кислоты на α-аминокислоты (см. 4.3). При этом образуется соответствующая α-гидроксикислота и выделяется газообразный азот, по объему которого судят о количестве вступившей в реакцию аминокислоты (метод Ван-Слайка).
Ксантопротеиновая реакция. Эта реакция используется для обнаружения ароматических и гетероциклических аминокислот - фенилаланина, тирозина, гистидина, триптофана. Например, при действии концентрированной азотной кислоты на тирозин образуется нитропроизводное, окрашенное в желтый цвет. В щелочной среде окраска становится оранжевой в связи с ионизацией фенольной гидроксильной группы и увеличением вклада аниона в сопряжение.

Существует также ряд частных реакций, позволяющих обнаруживать отдельные аминокислоты.
Триптофан обнаруживают при помощи реакции с п-(диметиламино)бензальдегидом в среде серной кислоты по появляющемуся красно-фиолетовому окрашиванию (реакция Эрлиха). Эта реакция используется для количественного анализа триптофана в продуктах расщепления белков.
Цистеин обнаруживают с помощью нескольких качественных реакций, основанных на реакционной способности содержащейся в нем меркаптогруппы. Например, при нагревании раствора белка с ацетатом свинца (СНзСОО)2РЬ в щелочной среде образуется черный осадок сульфида свинца PbS, что указывает на присутствие в белках цистеина.
12.1.5. Биологически важные химические реакции
В организме под действием различных ферментов осуществляется ряд важных химических превращений аминокислот. К таким пре- вращениям относятся трансаминирование, декарбоксилирование, элиминирование, альдольное расщепление, окислительное дезаминирование, окисление тиольных групп.
Трансаминирование является основным путем биосинтеза α-ами- нокислот из α-оксокислот. Донором аминогруппы служит аминокислота, имеющаяся в клетках в достаточном количестве или избытке, а ее акцептором - α-оксокислота. Аминокислота при этом превращается в оксокислоту, а оксокислота - в аминокислоту с соответствующим строением радикалов. В итоге трансаминирование представляет обратимый процесс взаимообмена амино- и оксо- групп. Пример такой реакции - получение l-глутаминовой кислоты из 2-оксоглутаровой кислоты. Донорной аминокислотой может служить, например, l-аспарагиновая кислота.

α-Аминокислоты содержат в α-положении к карбоксильной группе электроноакцепторную аминогруппу (точнее, протонированную аминогруппу NH 3 +), в связи с чем способны к декарбоксилированию.
Элиминирование свойственно аминокислотам, у которых в боковом радикале в β-положении к карбоксильной группе содержится электроноакцепторная функциональная группа, например гидроксильная или тиольная. Их отщепление приводит к промежуточным реакционноспособным α-енаминокислотам, легко переходящим в таутомерные иминокислоты (аналогия с кето-енольной таутомерией). α-Иминокислоты в результате гидратации по связи C=N и последующего отщепления молекулы аммиака превращаются в α-оксокислоты.

Такой тип превращений имеет название элиминирование-гидратация. Примером служит получение пировиноградной кислоты из серина.
Альдольное расщепление происходит в случае α-аминокислот, у которых в β-положении содержится гидроксильная группа. Например, серин расщепляется с образованием глицина и формальдегида (последний не выделяется в свободном виде, а сразу связывается с коферментом).
Окислительное дезаминирование может осуществляться с участием ферментов и кофермента НАД+ или НАДФ+ (см. 14.3). α-Аминокислоты могут превращаться в α-оксокислоты не только через трансаминирование, но и путем окислительного дезаминирования. Например, из l-глутаминовой кислоты образуется α-оксоглутаровая кислота. На первой стадии реакции осуществляется дегид- рирование (окисление) глутаминовой кислоты до α-иминоглутаровой
кислоты. На второй стадии происходит гидролиз, в результате которого получаются α-оксоглутаровая кислота и аммиак. Стадия гидролиза протекает без участия фермента.

В обратном направлении протекает реакция восстановительного аминирования α-оксокислот. Всегда содержащаяся в клетках α-оксоглутаровая кислота (как продукт метаболизма углеводов) превращается этим путем в L-глутаминовую кислоту.
Окисление тиольных групп лежит в основе взаимопревращений цистеиновых и цистиновых остатков, обеспечивающих ряд окислительно-восстановительных процессов в клетке. Цистеин, как и все тиолы (см. 4.1.2), легко окисляется с образованием дисульфида - цистина. Дисульфидная связь в цистине легко восстанавливается с образованием цистеина.

Благодаря способности тиольной группы к легкому окислению цистеин выполняет защитную функцию при воздействии на орга- низм веществ с высокой окислительной способностью. Кроме того, он был первым лекарственным средством, проявившим противолучевое действие. Цистеин используется в фармацевтической практике в качестве стабилизатора лекарственных препаратов.
Превращение цистеина в цистин приводит к образованию дисульфидных связей, например, в восстановленном глутатионе
(см. 12.2.3).
12.2. Первичная структура пептидов и белков
Условно считают, что пептиды содержат в молекуле до 100 (что соответствует молекулярной массе до 10 тыс.), а белки - более 100 аминокислотных остатков (молекулярная масса от 10 тыс. до нескольких миллионов).
В свою очередь, в группе пептидов принято различать олигопептиды (низкомолекулярные пептиды), содержащие в цепи не более 10 аминокислотных остатков, и полипептиды, в состав цепи которых входит до 100 аминокислотных остатков. Макромолекулы с числом аминокислотных остатков, приближающимся или немного превышающим 100, не разграничивают по понятиям полипептиды и белки, эти термины часто используют как синонимы.
Пептидную и белковую молекулу формально можно представить как продукт поликонденсации α-аминокислот, протекающей с обра- зованием пептидной (амидной) связи между мономерными звеньями (схема 12.2).
Конструкция полиамидной цепи одинакова для всего многообразия пептидов и белков. Эта цепь имеет неразветвленное строение и состоит из чередующихся пептидных (амидных) групп -СО-NH- и фрагментов -CH(R)-.
Один конец цепи, на котором находится аминокислота со свободной группой NH 2, называют N-концом, другой - С-концом,
Схема 12.2. Принцип построения пептидной цепи

на котором находится аминокислота со свободной группой СООН. Пептидные и белковые цепи записывают с N-конца.
12.2.1. Строение пептидной группы
В пептидной (амидной) группе -СО-NH- атом углерода находится в состоянии sp2-гибридизации. Неподеленная пара электронов атома азота вступает в сопряжение с π-электронами двойной связи С=О. С позиций электронного строения пептидная группа представляет собой трехцентровую p,π-сопряженную систему (см. 2.3.1), электронная плотность в которой смещена в сторону более электроотрицательного атома кислорода. Атомы С, Ои N, образующие сопряженную систему, находятся в одной плоскости. Распределение электронной плотности в амидной группе можно представить с по- мощью граничных структур (I) и (II) или смещения электронной плотности в результате +M- и - M-эффектов групп NH и C=O соответственно (III).

В результате сопряжения происходит некоторое выравнивание длин связей. Двойная связь С=О удлиняется до 0,124 нм против обычной длины 0,121 нм, а связь С-N становится короче - 0,132 нм по сравнению с 0,147 нм в обычном случае (рис. 12.1). Плоская сопряженная система в пептидной группе служит причиной затруднения вращения вокруг связи С-N (барьер вращения составляет 63-84 кДж/моль). Таким образом, электронное строение предопре- деляет достаточно жесткую плоскую структуру пептидной группы.
Как видно из рис. 12.1, α-атомы углерода аминокислотных остатков располагаются в плоскости пептидной группы по разные стороны от связи С-N, т. е. в более выгодном тpанс-положении: боковые радикалы R аминокислотных остатков в этом случае будут наиболее удалены друг от друга в пространстве.
Полипептидная цепь имеет удивительно однотипное строение и может быть представлена в виде ряда расположенных под углом друг

Рис. 12.1. Плоскостное расположение пептидной группы -CO-NH- и α-атомов углерода аминокислотных остатков
к другу плоскостей пептидных групп, соединенных между собой через α-атомы углерода связями Сα-N и Сα-Сsp 2 (рис. 12.2). Вращение вокруг этих одинарных связей весьма ограничено вследствие затруднений в пространственном размещении боковых радикалов аминокислотных остатков. Таким образом, электронное и пространственное строение пептидной группы во многом предопределяет структуру полипептидной цепи в целом.

Рис. 12.2. Взаимное положение плоскостей пептидных групп в полипептидной цепи
12.2.2. Состав и аминокислотная последовательность
При единообразно построенной полиамидной цепи специфичность пептидов и белков определяется двумя важнейшими характе- ристиками - аминокислотным составом и аминокислотной последовательностью.
Аминокислотный состав пептидов и белков - это природа и количественное соотношение входящих в них α-аминокислот.
Аминокислотный состав устанавливается путем анализа пептидных и белковых гидролизатов в основном хроматографическими методами. В настоящее время такой анализ осуществляется с помощью аминокислотных анализаторов.
Амидные связи способны гидролизоваться как в кислой, так и щелочной среде (см. 8.3.3). Пептиды и белки гидролизуются с образованием либо более коротких цепей - это так называемый частичный гидролиз, либо смеси аминокислот (в ионной форме) - полный гидролиз. Обычно гидролиз осуществляют в кислой среде, так как в условиях щелочного гидролиза многие аминокислоты неустойчивы. Следует отметить, что гидролизу подвергаются также амидные группы аспарагина и глутамина.

Первичная структура пептидов и белков - это аминокислотная последовательность, т. е. порядок чередования α-аминокислотных остатков.
Первичную структуру определяют путем последовательного отщепления аминокислот с какого-либо конца цепи и их идентификации.
12.2.3. Строение и номенклатура пептидов
Названия пептидов строят путем последовательного перечисления аминокислотных остатков, начиная с N-конца, с добавлением суффикса -ил, кроме последней С-концевой аминокислоты, для которой сохраняется ее полное название. Другими словами, названия
аминокислот, вступивших в образование пептидной связи за счет «своей» группы СООН, оканчиваются в названии пептида на -ил: аланил, валил и т. п. (для остатков аспарагиновой и глутаминовой кислот используют названия «аспартил» и «глутамил» соответствен- но). Названия и символы аминокислот означают их принадлежность к l -ряду, если не указано иное (d или dl ).

Иногда в сокращенной записи символами Н (как часть аминогруппы) и ОН (как часть карбоксильной группы) уточняется незамещенность функциональных групп концевых аминокислот. Этим способом удобно изображать функциональные производные пептидов; например, амид приведенного выше пептида по С-концевой аминокислоте записывается Н-Asn-Gly-Phe-NH2.
Пептиды содержатся во всех организмах. В отличие от белков они имеют более разнородный аминокислотный состав, в частнос- ти, довольно часто включают аминокислоты d -ряда. В структурном отношении они также более разнообразны: содержат циклические фрагменты, разветвленные цепи и т. д.
Один из наиболее распространенных представителей трипептидов - глутатион - содержится в организме всех животных, в растениях и бактериях.

Цистеин в составе глутатиона обусловливает возможность существования глутатиона как в восстановленной, так и окисленной форме.

Глутатион участвует в ряде окислительно-восстановительных процессов. Он выполняет функцию протектора белков, т. е. вещества, предохраняющего белки со свободными тиольными группами SH от окисления с образованием дисульфидных связей -S-S-. Это касается тех белков, для которых такой процесс нежелателен. Глутатион в этих случаях принимает на себя действие окислителя и таким образом «защищает» белок. При окислении глутатиона происходит межмолекулярное сшивание двух трипептидных фрагментов за счет дисульфидной связи. Процесс обратим.
12.3. Вторичная структура полипептидов и белков
Для высокомолекулярных полипептидов и белков наряду с первичной структурой характерны и более высокие уровни организа- ции, которые называют вторичной, третичной и четвертичной струк- турами.
Вторичная структура описывается пространственной ориентацией основной полипептидной цепи, третичная - трехмерной архитектурой всей белковой молекулы. Как вторичная, так и третичная структура связана с упорядоченным расположением макромолекулярной цепи в пространстве. Третичная и четвертичная структура белков рассматривается в курсе биохимии.
Расчетным путем было показано, что для полипептидной цепи одной из наиболее выгодных конформаций является расположение в пространстве в виде правозакрученной спирали, названной α-спиралью (рис. 12.3, а).
Пространственное расположение α-спирализованной полипептидной цепи можно представить, вообразив, что она обвивает некий

Рис. 12.3. α-Спиральная конформация полипептидной цепи
цилиндр (см. рис. 12.3, б). На один виток спирали в среднем приходится 3,6 аминокислотного остатка, шаг спирали составляет 0,54 нм, диаметр - 0,5 нм. Плоскости двух соседних пептидных групп располагаются при этом под углом 108?, а боковые радикалы аминокислот находятся на наружной стороне спирали, т. е. направлены как бы от поверхности цилиндра.
Основную роль в закреплении такой конформации цепи играют водородные связи, которые в α-спирали образуются между кар- бонильным атомом кислорода каждого первого и атомом водорода NН-группы каждого пятого аминокислотного остатка.

Водородные связи направлены почти параллельно оси α-спирали. Они удерживают цепь в закрученном состоянии.
Обычно белковые цепи спирализованы не полностью, а лишь частично. В таких белках, как миоглобин и гемоглобин, содержатся довольно длинные α-спиральные участки, например цепь миоглобина
спирализована на 75%. Во многих других белках доля спиральных участков в цепи может быть небольшой.
Другим видом вторичной структуры полипептидов и белков является β-структура, называемая также складчатым листом, или складчатым слоем. В складчатые листы укладываются вытянутые полипептидные цепи, связываемые множеством водородных связей между пептидными группами этих цепей (рис. 12.4). Во многих белках одновременно содержатся α-спиральные и β-складчатые структуры.

Рис. 12.4. Вторичная структура полипептидной цепи в виде складчатого листа (β-структура)
Аминокислоты - главный строительный материал любого живого организма. По своей природе они являются первичными азотистыми веществами растений, которые синтезируются из почвы. Строение и и аминокислот зависят от их состава.
Структура аминокислоты
Каждая ее молекула имеет карбоксильные и аминные группы, которые соединены с радикалом. Если аминокислота содержит 1 карбоксильную и 1 амино-группу, строение ее можно обозначить формулой, представленной ниже.

Аминокислоты, которые имеют 1 кислотную и 1 щелочную группу, называют моноаминомонокарбоновыми. В организмах также синтезируются и функции которых обусловливают 2 карбоксильных группы или 2 аминных группы. Аминокислоты, содержащие 2 карбоксильные и 1 аминную группы, называют моноаминодикарбоновыми, а имеющие 2 аминные и 1 карбоксильную - диаминомонокарбоновыми.
Также они различны по строению органического радикала R. У каждой из них имеется свое наименование и структура. Отсюда и различные функции аминокислот. Именно наличие кислотной и щелочной групп обеспечивает ее высокую реактивность. Эти группы соединяют аминокислоты и образуют полимер - белок. Белки еще именуются полипептидами из-за своего строения.
Аминокислоты как строительный материал
Молекула белка - это цепочка из десятков или сотен аминокислот. Белки отличаются по составу, количеству и порядку расположения аминокислот, ведь число сочетаний из 20 составляющих практически бесконечно. Одни из них имеют весь состав незаменимых аминокислот, иные обходятся без одной или нескольких. Отдельные аминокислоты, структура, функции которых подобны белкам человеческого тела, не применяются в качестве пищевых, так как малорастворимы и не расщепляются ЖКТ. К таким принадлежат белки ногтей, волос, шерсти или перьев.
Функции аминокислот трудно переоценить. Эти вещества выступают главной пищей в рационе людей. Какую функцию выполняют аминокислоты? Они увеличивают рост мышечной массы, помогают укреплению суставов и связок, восстанавливают поврежденные ткани организма и участвуют во всех процессах, происходящих в теле человека.

Незаменимые аминокислоты
Только из добавок или пищевых продуктов можно получить Функции в процессе формирования здоровых суставов, крепких мышц, красивых волос очень значимы. К таким аминокислотам относятся:
- фенилаланин;
- лизин;
- треонин;
- метионин;
- валин;
- лейцин;
- триптофан;
- гистидин;
- изолейцин.
Функции аминокислот незаменимых
Эти кирпичики выполняют важнейшие функции в работе каждой клетки человеческого организма. Они незаметны, пока поступают в организм в достаточном количестве, но их недостаток существенно ухудшает работу всего организма.
- Валин возобновляет мышцы, служит отличным источником энергии.
- Гистидин улучшает состав крови, способствует восстановлению и росту мышц, улучшает работу суставов.
- Изолейцин помогает выработке гемоглобина. Контролирует количество сахара в крови, повышает энергичность человека, выносливость.
- Лейцин укрепляет иммунитет, следит за уровнем сахара и лейкоцитов в крови. Если уровень лейкоцитов завышен: он их понижает и подключает резервы организма для ликвидации воспаления.
- Лизин помогает усвоению кальция, что формирует и укрепляет кости. Помогает выработке коллагена, улучшает структуру волос. Для мужчин это отличный анаболик, так как он наращивает мышцы и увеличивает мужскую силу.
- Метионин нормализует работу пищеварительной системы и печени. Участвует в расщеплении жиров, убирает токсикоз у беременных, благотворно влияет на волосы.
- Треонин улучшает работу ЖКТ. Повышает иммунитет, участвует в создании эластина и коллагена. Треонин препятствует отложению жира в печени.
- Триптофан отвечает за эмоции человека. Вырабатывает серотонин - гормон счастья, тем самым нормализует сон, поднимает настроение. Укрощает аппетит, благотворительно влияет на сердечную мышцу и артерии.
- Фенилаланин служит передатчиком сигналов от нервных клеток в мозг головы. Улучшает настроение, подавляет нездоровый аппетит, улучшает память, повышает восприимчивость, снижает боль.
Дефицит незаменимых аминокислот приводит к остановке роста, нарушению обмена веществ, снижению мышечной массы.

Заменимые аминокислоты
Это такие аминокислоты, строение и функции которых вырабатываются в организме:
- аргинин;
- аланин;
- аспарагин;
- глицин;
- пролин;
- таурин;
- тирозин;
- глутамат;
- серин;
- глутамин;
- орнитин;
- цистеин;
- карнитин.
Функции аминокислот заменимых
- Цистеин ликвидирует токсические вещества, участвует в создании тканей кожи и мышц, представляет собой естественный антиоксидант.
- Тирозин снижает физическую усталость, ускоряет метаболизм, ликвидирует стресс и депрессию.
- Аланин служит для роста мускулатуры, является источником энергии.
- увеличивает метаболизм и снижает образование аммиака при больших нагрузках.
- Цистин устраняет боль при травмировании связок и суставов.
- отвечает за мозговую активность, во время длительных физических нагрузок переходит в глюкозу, вырабатывая энергию.
- Глутамин восстанавливает мышцы, повышает иммунитет, ускоряет метаболизм, усиливает работу мозга и создает гормон роста.
- Глицин необходим для работы мышц, расщепления жира, стабилизации артериального давления и сахара в крови.
- Карнитин перемещает жировые кислоты в клетки, где совершается их расщепление с выделением энергии, в результате чего сжигается лишний жир и генерируется энергия.
- Орнитин производит гормон роста, участвует в процессе мочеобразования, расщепляет жирные кислоты, помогает выработке инсулина.
- Пролин обеспечивает производство коллагена, он необходим для связок и суставов.
- Серин повышает иммунитет и вырабатывает энергию, нужен для быстрого метаболизма жирных кислот и роста мышц.
- Таурин расщепляет жир, поднимает сопротивляемость организма, синтезирует желчные соли.
Белок и его свойства
Белки, или протеины - высокомолекулярные соединения с содержанием азота. Понятие "протеин", впервые обозначенное Берцелиусом в 1838 г., происходит от греческого слова и означает "первичный", что отображает лидирующее значение протеинов в природе. Разновидность белков дает возможность для существования огромного количества живых существ: от бактерий до человеческого организма. Их существенно больше, чем других макромолекул, ведь белки - это фундамент живой клетки. Составляют приблизительно 20% от массы человеческого тела, больше 50% сухой массы клетки. Такое количество разнообразных белков объясняется свойствами двадцати различных аминокислот, которые взаимодействуют друг с другом и создают полимерные молекулы.

Выдающееся свойство белков - способность к самостоятельному созданию определенной, свойственной конкретному белку пространственной структуры. По белки - это биополимеры с пептидными связями. Для химического состава белков свойственно постоянное среднее содержание азота - приблизительно 16%.
Жизнь, а также рост и развитие организма невозможны без функции белковых аминокислот строить новые клетки. Белки нельзя заменить прочими элементами, их роль в человеческом организме является чрезвычайно важной.
Функции белков
Необходимость белков заключается в таких функциях:
- он необходим для роста и развития, так как выступает главным строительным материалом для создания новых клеток;
- управляет метаболизмом, во время которого освобождается энергия. После принятия пищи скорость метаболизма увеличивается, например, если еда состоит из углеводов, метаболизм ускоряется на 4%, если из белков - на 30%;
- регулируют в организме, благодаря своей гидрофильности - способности притягивать воду;
- усиливают работу иммунной системы, синтезируя антитела, которые защищают от инфекции и ликвидируют угрозу заболевания.

Продукты - источники белков
Мышцы и скелет человека состоят из живых тканей, которые на протяжении жизни не только функционируют, но и обновляются. Восстанавливаются после повреждений, сохраняют свою силу и прочность. Для этого им требуются вполне определенные питательные вещества. Пища обеспечивает организм энергией, необходимой для всех процессов, включая работу мышц, рост и восстановление тканей. А белок в организме используется и как источник энергии, и как стройматериал.

Поэтому очень важно соблюдать его ежедневное использование в пищу. Богатые белком продукты: курица, индейка, постная ветчина, свинина, говядина, рыба, креветки, фасоль, чечевица, бекон, яйца, орех. Все эти продукты обеспечивают организм белком и дают энергию, необходимую для жизни.
) имеют важное значение для мышечной энергии и роста, но вы можете не знать, какое соотношение ВСАА является наилучшим. Предлагаем вашему вниманию ряд рекомендаций от настоящего гуру спортивных добавок, доктора наук Джима Стоппани!
Я встречал препараты ВСАА с самым разным соотношением аминокислот – от 2:1:1 до 10:1:1. Но какая пропорция ВСАА является наилучшей?
Мои постоянные читатели наверняка уже хорошо разбираются в преимуществах аминокислот с разветвленной цепью (ВСАА), которые представлены тремя основными аминокислотами – лейцин, изолейцин и валин. Однако, учитывая, что различные добавки содержат различные соотношения этих трех важнейших аминокислот, существует много путаницы относительно того, какая пропорция ВСАА является наилучшей. Прежде чем мы углубимся в этот вопрос, рассмотрим суть и принцип действия аминокислот с разветвленной цепью.
ВСАА называют аминокислотами с разветвленной цепью ввиду их структуры. Каждая молекула имеет раздвоенный фрагмент, напоминающий ветвь. Помимо особенностей структурного строения, они также особенны по многочисленным другим причинам.
ВСАА генерируют энергию и содействуют сжиганию жира, но главным преимуществом ВСАА является их способность стимулировать рост мышц, а ведь это цель номер один для большинства из нас. Когда дело доходит до построения мышц, являются крайне необходимыми аминокислотами. Важнейшей из трех является лейцин, который играет наиболее значительную роль в стимулировании мышечного роста.
Лейцин – аминокислота №1
Действие лейцина подобно функции ключа в замке зажигания автомобиля. Автомобилем в данном случае являются мышечные клетки и волокна. Зажигание включает процесс синтеза мышечного белка, который аккумулируется в мышцах белка, что приводит к их большему росту. Говоря научным языком, лейцин активизирует комплекс под названием MTOR (рапамицин-ассоциированный белок), который ускоряет синтез мышечного белка и, следовательно, приводит к росту мышц.
Исследования показывают, что у людей, которые добавляют лейцин в пост-тренировочный прием протеинов и углеводов, синтез мышечного белка ускоряется в значительно большей степени, чем у тех, кто употребляет исключительно протеин и углеводы. И именно потому, что лейцин имеет столь важное значение для роста мышц, все, естественно, стараются убедиться, что используют продукт, содержание лейцина в котором больше, чем его товарищей – изолейцина и валина.
Правильное соотношение
Я рекомендую вам использовать BCAA добавку с соотношением лейцина, изолейцина и валина 2:1:1. Во многих спортивных добавках пропорция значительно увеличена в пользу лейцина: в одних – до 8:1:1, в других – до ударного соотношения 10:1:1. Многие люди считают, что, с учетом ведущей роли лейцина в стимулировании роста мышц, BCAA добавка с соотношением ингредиентов 10:1:1 действует в пять раз лучше, чем с соотношением 2:1:1. Но прежде чем вы отправитесь тратить с трудом заработанные деньги на эти якобы высококачественные пищевые добавки, выслушайте меня внимательно.
Оптимальное время для приема ВСАА наступает в период ваших тренировок, равноценно эффективно делать это как до, так и во время или после них. (И да, это в дополнение к протеиновому коктейлю, обогащенному аминокислотами). Одной из причин этого является то, что вам необходимо достаточно лейцина, чтобы спровоцировать синтез мышечного белка. Именно этот факт побуждает многих людей считать, что чем выше коэффициент лейцина в добавке, тем лучше.
Прием некоторых добавок даже предполагает, что вы должны отказаться от двух других ВСАА и принимать только лейцин. Это большая ошибка. С целью доказать это, исследователи сравнивали воздействие лейцина самого по себе с приемом всех трех ВСАА в соотношении 2:1:1. Ученые из Университета Бэйлор испытывали парней студенческого возраста, одна группа которых до и после тренировки на ноги принимала добавку с лейцином, другая - BCAA добавку с пропорцией аминокислот 2:1:1, а третья – плацебо-препараты. Было выявлено, что хотя у принимающих лейцин синтез мышечного белка после тренировки увеличился в большей степени, чем у плацебо-группы, результаты увеличения синтеза белка в группе, принимающей комплексные ВСАА, оказались значительно лучшими, чем у всех других испытуемых. Это одна из причин для выбора пропорции 2:1:1 (или близкой к ней) при приеме спортивных добавок с ВСАА.
Еще одна причина, чтобы использовать добавку с соотношением аминокислот 2:1:1 – это цель увеличения энергии и одновременно уменьшения усталости. ВСАА используются непосредственно мышечными волокнами в качестве источника топлива. Это особенно справедливо во время интенсивных физических упражнений, например, силовых тренировок. Многочисленные исследования показывают, что прием ВСАА перед тренировкой способствует увеличению мышечной выносливости. Что еще более важно, ВСАА помогают уменьшить усталость во время тренировок. Происходит это благодаря той важной роли, которую играет в нашем организме аминокислота валин.
Во время тренировок мозг в больших количествах поглощает триптофан. Триптофан превращается в мозге в 5-гидрокситриптамин, более известный как серотонин. Более высокие уровни серотонина во время тренировки подают сигнал мозгу, что тело утомлено. Это приводит к снижению мышечной силы и выносливости. Валин конкурирует с триптофаном на стадии поступления в головной мозг. И, как правило, валин выигрывает.
Это означает, что, если вы принимаете аминокислоту валин до и/или во время тренировок, меньшее количество триптофана попадает в мозг и преобразовывается в серотонин. Это позволяет мышцам сокращаться с большей силой в течение более длительного времени, прежде чем наступит усталость. Другими словами, вы сможете делать больше повторений в тренажерном зале, быстрее восстанавливаться между подходами и сохранять больше силы и выносливости на завершающем этапе тренировок. Валин также может помочь вам повысить концентрацию и стимулирует работу головного мозга в те дни, когда у вас нет тренировок.
По вышеописанным причинам при приеме спортивных добавок с аминокислотами до, во время и/или после тренировок я рекомендую вам придерживаться пропорции 2:1:1 лейцина к изолейцину и валину.
Максимизируем жигание жира
Если вы заинтересованы в максимизации сжигания жира, есть еще одна причина, почему соотношение аминокислот 2:1:1 является оптимальным. В этом случае на помощь приходит изолейцин. Изолейцин играет ключевую роль в обеспечении жиросжигающего эффекта ВСАА.
Японские исследователи установили, что мыши, которым добавляли изолейцин во время приема пищи с высоким содержанием жиров, набрали значительно меньше жира, чем мыши, которые не получали дополнительный изолейцин. Это связано с возможностью изолейцина активировать специальные рецепторы, известные как PPAR, которые увеличивают сжигание жира и препятствуют его отложению. Функция PPAR заключается в повышении активности генов, которые способствуют большему сжиганию жира в организме путем уменьшения активности генов, которые обычно увеличивают накопление жира.
На самом деле, спортивные добавки с соотношением аминокислот намного выше, чем 2:1:1, могут в каком-то смысле даже препятствовать сохранению энергии, потере жира и росту мышц. Некоторые BCAA-добавки с повышенным содержанием лейцина обеспечивают только 500 мг или меньше валина и изолейцина. Держитесь подальше от таких препаратов! Такого количества вышеуказанных аминокислот не достаточно, чтобы поддерживать энергию и снижать усталость во время тренировок. Его также не достаточно, чтобы увеличить синтез белка в мышцах и, следовательно, способствовать росту мышц.
Вывод
Я рекомендую вам принимать с соотношением аминокислот 2:1:1, обеспечивающие по крайней мере 1 грамм изолейцина и 1 грамм валина на дозу. Но если вы стремитесь к максимальному результату, необходимо в первую очередь ориентироваться на показатель приема по крайней мере 3 граммов лейцина на дозу. Это то минимальное количество, которое необходимо для оптимизации действия MTOR и максимизации синтеза мышечного белка.
Мой совет – принимать 5 г ВСАА в пропорции 2:1:1 (до 3 г лейцина, и немного более 1 г изолейцина и валина) за 30 минут до тренировок.
После тренировки рекомендую принять аналогичную дозу аминокислот. Здесь соотношение 2:1:1 опять же является оптимальным. Пропорция 3:1:1, которая предполагает немного большее содержание лейцина в посттренировочной добавке для инициации синтеза белка, также окажет благоприятный эффект.
Обратите внимание, что ВСАА-препараты следует принимать в дополнение к пред- и посттренировочным коктейлям или одной большой порции протеинового коктейля, которую вы потягиваете до, во время и после тренировки. Этот обогащенный аминокислотами коктейль сам по себе немного повысит поступление в организм BCAA, но не волнуйтесь: вам по-прежнему необходимы три эти важнейшие свободные аминокислоты с разветвленной боковой цепью в спортивных добавках для достижения по-настоящему максимального энергетического эффекта и мышечного роста.
Последние материалы сайта
Разное

Исследовательская работа по физкультуре на тему «Роль физических упражнений в формировании осанки школьников Готовые работы по физкультуре
МОУ «Лихославльская СОШ №2» «Роль физических упражнений в формировании осанки школьников» Выполнили ученицы 8 «а» класса Кабирова Сабина Калейчик Валерия Руководитель: Умарова Ф.Б., Учитель физической культуры г. Лихославль Введение…………………………………………………………
Разное

Майкл Оуэн. Биографии игроков. Майкл Оуэн Из Франции героем
Майкл Оуэн, осознав, что его попытка вернуться в большой футбол в "Стоуке" не приносит радости ни ему самому, ни его новым работодателям объявил о завершении карьеры по окончании сезона. Карьера его не была американскими горками – это был обычный слаломны
Упражнения
Способы общего обезболивания: ингаляционный, неингаляционный наркоз
В настоящее время выделяют 2 вида анестезии: общая (наркоз) и местная. Общая анестезия (наркоз) - простой (однокомпонентный) и комбинированный (многокомпонентный). При простом наркозе выключение сознания, аналгезия и мышечная релаксация достигаются од
Мотивируй себя

Что означает выражение "вожжа под хвост попала", приведите примеры?
Вожжа под хвост попала кому. Прост. Неодобр . Кто-л. находится в состоянии раздражения, проявляет взбалмошность, сумасбродство. ФСРЯ, 74; Верш. 7, 191; БТС, 141, 1441; СПП 2001, 22. Большой словарь русских поговорок. - М: Олма Медиа Групп . В. М. Мокиен
Разное

Почему появляется целлюлит Из за чего возникает целлюлит
В настоящее время проблемы сохранения или/и восстановления эстетичности внешнего вида становятся все более актуальными. Эстетическое здоровье оказывает значительное влияние на адаптацию человека в обществе, качество его жизни и социальное благополучие.В с
Виды спорта
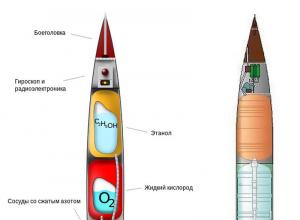
После нас тишина рвсн. «После нас – тишина. О тонкостях обучения в ракетных войсках
Таков девиз, принятый в российских Ракетных Войсках Стратегического Назначения, главной ударной силы нашей армии. И, хотя девиз этот, разумеется, не является официальным, он обрел такую популярность, настолько прижился в воинских коллективах ракетчиков, ч