Миорелаксанты и особенности их применения. Способы общего обезболивания: ингаляционный, неингаляционный наркоз. Мышечные релаксанты. Механизм действия мышечных релаксантов. Осложнения при применении релаксантов Классификация миорелаксантов по химической с
В настоящее время выделяют 2 вида анестезии: общая (наркоз) и местная. Общая анестезия (наркоз) - простой (однокомпонентный) и комбинированный (многокомпонентный).
При простом наркозе выключение сознания, аналгезия и мышечная релаксация достигаются одним анестетиком. К достоинствам этого вида наркоза следует отнести относительную простоту. Недостатком следует считать необходимость высокой концентрации анестетика, что ведет к усилению его негативных и побочных действий на органы и системы.
Простая общая анестезия подразделяется на ингаляционную и неингаляционную.
Мышечные релаксанты - это препараты, расслабляющие поперечнополосатую мускулатуру. Различают релаксанты центрального и периферического действия. К релаксантам центрального действия относятся транквилизаторы, но их миорелаксирующий эффект связан не с периферическим курарепо-добным действием, а с влиянием на ЦНС. Мышечные релаксанты периферического действия в связи с особенностями влияния на процесс синаптической передачи подразделяются на две группы.
1. Недеполяризующие миорелаксанты. К ним относятся тракриум, паву-лон, ардуан, норкурон, нимбекс. Они парализуют нервно-мышечную передачу вследствие того, что уменьшают чувствительность Н-холинорецепторов синаптической области к ацетилхолину и тем самым исключают возможность деполяризации концевой пластинки и возбуждения мышечного волокна. Соединения этой группы являются истинными курареподобными веществами. Фармакологические антагонисты этих соединений - антихолинэстеразные вещества (прозерин, галантамин): угнетая активность холинэстеразы, они приводят к накоплению в области синапсов ацетилхолина, который с повышением концентрации ослабляет взаимодействие курареподобных веществ с Н-холинорецеп-торами и восстанавливает нервно-мышечную передачу.
2. Деполяризующие миорелаксанты вызывают мышечное расслабление, оказывая холиномиметическое действие, сопровождающееся стойкой деполяризацией, что также нарушает проведение возбуждения с нерва на мышцу. Препараты этой группы быстро гидролизуются холинэстеразой; антихолинэстеразные препараты усиливают их действие. Представителем этой группы является сукцинилхолин (дитилин, листенон).
В зависимости от длительности вызываемого нервно-мышечного блока, миорелаксанты подразделяются на 3 группы:
A) вызывающие быстро развивающуюся нервно-мышечную блокаду (в течение 1 мин), но с коротким периодом действия (до 15 мин) - сукцинилхолин.
B) вызывающие быстро развивающуюся нервно-мышечную блокаду со средней продолжительностью действия (15-30 мин) - норкурон, тракриум, нимбекс.
С) вызывающие нервно-мышечную блокаду с длительным периодом действия (30-150 мин) - ардуан, павулон.
Миорелаксанты должны применяться только при выключенном сознании больного.
11.Клиническое течение наркоза. Масочный наркоз. Эндотрахеальный наркоз. Внутривенный наркоз. Показания, противопоказания. Осложнения и борьба с ними.
Ингаляционная анестезия.
Основана на введении общих ингаляционных анестетиков в виде газонаркотической смеси в дыхательные пути больного с последующей диффузией их из альвеол в кровь и дальнейшем насыщении тканей с развитием состояния наркоза. Чем выше концентрация анестетика в дыхательной смеси и больше минутный объем дыхания, тем быстрее достигается необходимая глубина наркоза при прочих равных условиях. Основным преимуществом ингаляционной анестезии является его управляемость и возможность легко поддерживать нужную концентрацию анестетика в крови. Относительным недостатком считается необходимость в специальной аппаратуре (наркозные аппараты).
Наркозный аппарат - прибор, с помощью которого обеспечиваются:
а) дозированная подача в дыхательные пути газообразных и летучих анестетиков, кислорода или воздуха;
б) поддержание необходимой влажности и температуры вдыхаемой газонаркотической смеси;
в) удаление из дыхательных путей выдыхаемой смеси;
г) элиминация углекислого газа из выдыхаемой смеси;
д) вспомогательная или искусственная вентиляция легких. \
Наркозные аппараты состоят из трех основных узлов:
1) емкости для кислорода и газообразных анестетиков (баллоны с редукторами);
2) испарителя для жидких анестетиков и блока дозиметров для газообразных анестетиков, кислорода и воздуха;
3) дыхательного контура, обеспечивающего циркуляцию газонаркотической смеси.
В зависимости от источника поступления вдыхаемой смеси, от того, куда направлен вдыхаемый газ, а также от схемы движения газонаркотической смеси различают несколько дыхательных контуров: открытый, полуоткрытый, закрытый и полузакрытый.
При открытом контуре вдох и выдох осуществляются из атмосферы и в атмосферу. Во время вдоха поток воздуха захватывает пары анестетика, которые поступают в дыхательные пути. В настоящее время этот метод применяется крайне редко, хотя имеет свои преимущества: простота, минимальное сопротивление дыханию, отсутствие мертвопростран-ственного эффекта. Недостатки: невозможность точного дозирования общего ингаляционного анестетика и проведения ИВЛ, недостаточная оксигенация, загрязнение операционной парами анестетика.
При полуоткрытом контуре газонаркотическая смесь поступает в дыхательные пути из баллонов, проходя через дозиметры и испарители, а выдох осуществляется в атмосферу. Преимущества: точное дозирование анестетика, возможность проведения ИВЛ. Недостатки: избыточная потеря тепла и влаги, относительно большое мертвое пространство, неэкономное применение общих ингаляционных анестетиков.
При закрытом контуре вдох осуществляется из аппарата, и вся выдыхаемая смесь возвращается в аппарат. При полузакрытом контуре вдох осуществляется из аппарата, а часть выдыхаемой смеси выбрасывается в атмосферу. Преимущества: экономия анестетиков и кислорода, незначительные потери тепла и влаги, небольшое сопротивление дыханию, меньшая загрязненность атмосферы операционной. Недостатки: возможность передозировки анестетика и гиперкапнии, необходимость контроля вдыхаемой и выдыхаемой концентрации анестетиков, проблема дезинфекции наркозного аппарата.
Общая ингаляционная анестезия вызывается газообразными и жидкими летучими ингаляционными анестетиками.
К газообразным анестетикам относится азота закись (веселящий газ) - бесцветный газ, тяжелее воздуха, без запаха. Из 1 кг жидкой закиси азота образуется 500 л газа. Находится в растворимом состоянии в плазме, После прекращения вдыхания выводится из организма в неизмененном виде через дыхательные пути (полностью через 10 минут). Слабый анестетик. Используется в комбинации с другими анестетиками. Применяется только в смеси с кислородом в соотношении 2:1. Выпускается в металлических баллонах серого цвета под давлением 50 атм. Исторический интерес имеет газообразный анестетик циклопропан - бесцветный горючий газ с характерным запахом и едким вкусом, мощный анестетик; в связи с выраженным токсическим эффектом на организм и взрывоопасностью в современной анестезиологии не применяется.
К жидким летучим ингаляционным анестетикам относятся фторотан (галотан, наркотан), метоксифлуран .
Фторотан - сильнодействующий галогенсодержащий анестетик, который в 50 раз сильнее закиси азота. Представляет собой бесцветную жидкость со сладковатым запахом. Фторотан вызывает быстрое, без неприятных ощущений наступление общей анестезии и быстрое пробуждение, не раздражает слизистые оболочки дыхательных путей, угнетает секрецию слюнных и бронхиальных желез, гортанные и глоточные рефлексы, оказывает бронхорасширяющее, ганглиоблокирующее действие, умеренно расслабляет поперечно-полосатую мускулатуру. Вместе с тем фторотан обладает прямым депрессивным влиянием на сократительную способность миокарда, вызывает снижение артериального давления, нарушает ритм сердечной деятельности, повышает чувствительность сердца к катехоламинам. Вводный наркоз осуществляют постепенным повышением фторотана до 2-3,5 об.% вместе с кислородом, поддержание анестезии - 0,5-1,5 об.% фторотана.
Метоксифлуран - галогенсодержащий анестетик, представляющий собой бесцветную жидкость со специфическим запахом. Обладает мощным анальгетическим эффектом с минимальным токсическим влиянием на организм, способностью стабилизировать ритм сердца и гемодинамику, снижать чувствительность сердца к адреналину, не вызывает раздражения слизистых оболочек дыхательных путей, подавляет гортанные и глоточные рефлексы, бронходилататор. Вместе с тем метоксифлуран токсически влияет на почки и печень, при глубокой и продолжительной анестезии угнетает сократительную способность миокарда. Вводный наркоз осуществляется постепенным увеличением концентрации до 2 об.%; для поддержания общей анестезии доза составляет 0,8-1 об.%. Исторический интерес представляют такие жидкие летучие ингаляционные анестетики как, диэтиловый эфир, хлороформ, хлорэтил, трихло-рэтилен, которые в связи с высокой токсичностью в современной анестезиологии не используются.
Ингаляционный наркоз можно проводить простой маской, аппаратно-масочным, эндотрахеальным и трахеостомическим способами.
Неингаляционная анестезия. При этом виде анестетики вызывают наркоз, попадая в организм любым возможным путем, кроме ингаляции через дыхательные пути. Неингаляционные анестетики можно вводить парентерально (внутривенно, внутримышечно), орально и ректально. Преимущество неингаляционной анестезии в ее простоте (нет необходимости в наркозной аппаратуре), в быстро наступающем вводном наркозе. Недостаток - малая управляемость.
Общие неингаляционные анестетики - гексенал, тиопентал-натрия, кетамин (кеталар, калипсол, велонаркон), пропофол (диприван) этомидат.
Производные барбитуровой кислоты (гексенал, тиопентал-натрия) представляют сухую пористую массу. Оба препарата легко образуют нестойкие водные растворы с резко щелочной реакцией (рН более 10), которые должны быть использованы в течение 1 часа с момента приготовления. Применяются 1-2,5% растворы в начальной дозе 5-10 мг/кг. Барбитуровый наркоз наступает через 30-60 сек. без возбуждения и продолжается 10-20 мин. Производные барбитуровой кислоты - сильные гипнотики, но слабые анальгетики, обладают небольшой широтой терапевтического действия, угнетают дыхательный центр и снижают сократительную способность миокарда. Барбитураты применяются для вводной и кратковременной анестезии.
Кетамин - анестетик короткого действия, обладающий мощным аналь-гезирующим свойством. Вызывает диссоциативную анестезию, так как угнетая одни структуры головного мозга (кору головного мозга), возбуждает другие (лимбические структуры мозга). Обладает большой широтой терапевтического действия. Внутривенное введение в дозе 2-3 мг/кг массы тела вызывает хирургическую стадию наркоза через 30 сек., длительность действия - 5-15 мин. Внутримышечно вводится из расчета 8-10 мг/кг, перорально - 10-14 мг/кг. Применяется для вводной анестезии, в малой хирургии, у тяжелобольных в состоянии шока, при транспортировке.
Этомидат - анестетик короткого действия, отличается чрезмерно большой широтой терапевтического действия. Применяется внутривенно в дозе 0,3 мг/кг, продолжительность хирургической стадии наркоза при этом 8-10 мин, которая наступает через 60 сек. Сильный гипнотик, очень слабый анальгетик.
Пропофол - анестетик короткого действия, применяется для вводной анестезии и поддержания анестезии посредством постоянной инфузии. Обладает слабым анальгетическим действием. Для вводной анестезии пропофол вводится внутривенно в дозе 2-2,5 мг/кг, хирургическая стадия наркоза при этом наступает через 30 сек. и продолжается 5-10 мин. Для поддержания адекватной анестезии устанавливается скорость постоянной инфузии пропофола в пределах 4-12 мг/кг/час. Угнетает сократительную способность миокарда, легко проникает через плацентарный барьер и вызывает неонатальную депрессию.
Исторический интерес представляют предион (виадрил), натрия оксибу-тират (ГОМК), пропанидид (сомбревин), алтезин, которые в настоящее время не применяются.
Комбинированный наркоз - широкое понятие, подразумевающее последовательное или одновременное использование различных анестетиков, а также сочетание их с другими препаратами: анальгетиками, транквилизаторами, миорелаксантами, обеспечивающими или усиливающими отдельные компоненты анестезии. В стремлении комбинировать различные анестетики заложена идея получить от каждого препарата лишь тот эффект, который наилучшим образом обеспечивается этим веществом, усиливать слабые эффекты одного анестетика за счет другого при одновременном снижении концентрации или дозы применяемых анестетиков. Различают:
1) комбинированный ингаляционный наркоз;
2) комбинированный неингаляционный наркоз;
3) комбинированный ингаляционный + неингаляционный наркоз;
4) комбинированный наркоз с миорелаксантами;
5) комбинированный наркоз с местной анестезией.
Стадии общего наркоза:
Первая стадия - СТАДИЯ АНАЛГЕЗИИ - начинается с момента начала введения общего анестетика и продолжается до потери сознания. Характерно: постепенное затемнение сознания, вначале происходит потеря ориентации, больные неправильно отвечают на вопросы; речь становится бессвязной, состояние полудремотным. Кожа лица гиперемирована, зрачки исходной величины или немного расширены, активно реагируют на свет. Дыхание и пульс немного учащены, артериальное давление повышено. Тактильная, температурная чувствительность и рефлексы сохранены, болевая чувствительность резко ослаблена, что позволяет в этой стадии выполнять кратковременные хирургические вмешательства и манипуляции (рауш-наркоз). В этой стадии предложено различать три фазы по Артузио (1954): первую - начало усыпления, когда еще не наступила полная аналгезия и амнезия, вторую - полная аналгезия и частичная амнезия, третью - развитие полной аналгезии и полной амнезии. Продолжительность стадии анелгезии зависит от общего состояния больного, его возраста, премедикации и применяемого общего анестетика и варьирует от нескольких секунд (при применении неингаляционных анестетиков) до 10 мин (при применении ингаляционных анестетиков).
Вторая стадия - СТАДИЯ ВОЗБУЖДЕНИЯ - начинается сразу же после потери сознания и продолжается до расслабления больного. Клиническая картина характеризуется речевым и двигательным возбуждением. Кожные покровы резко гиперемированы, веки сомкнуты, зрачки расширены, реакция их на свет сохранена, отмечаются слезотечение, плавательные движения глазных яблок. Мышцы резко напряжены (тризм), кашлевой, рвотный рефлексы усилены, пульс, дыхание учащены, аритмичные, артериальное давление повышено. Иногда отмечается непроизвольное мочеиспускание, кашель, рвота, нарушения ритма сердца. Хирургические вмешательства в этой стадии не допускаются из-за повышенного мышечного тонуса и рефлексов. Продолжительность второй стадии зависит от индивидуальных особенностей больного и применяемого общего анестетика и может быть от нескольких секунд (при использовании неингаляционных анестетиков) до 10 мин (при использовании ингаляционных анестетиков).
Третья стадия - ХИРУРГИЧЕСКАЯ - наступает, когда по мере насыщения организма анестетиком происходит торможение в коре головного мозга и подкорковых структурах. Клинически на фоне глубокого сна отмечаются потеря всех видов чувствительности, расслабление мышц, угнетение рефлексов, урежение и углубление дыхания. Пульс замедляется, артериальное давление несколько снижается. Кожные покровы бледно-розовые, сухие. Для контроля глубины общей анестезии и предотвращения передозировки в данной стадии различаются четыре уровня.
/ уровень - уровень движения глазных яблок - на фоне спокойного сна еще сохраняется мышечный тонус, гортанно-глоточные рефлексы. Дыхание ровное, пульс несколько учащен, артериальное давление на исходном уровне. Глазные яблоки совершают медленные кругообразные движения, зрачки равномерно сужены, живо реагируют на свет, роговичный рефлекс сохранен. Поверхностные рефлексы (кожные) исчезают.
2 уровень - уровень роговичного рефлекса. Глазные яблоки фиксированы, роговичный рефлекс исчезает, зрачки сужены, реакция их на свет сохранена. Гортанный и глоточный рефлексы отсутствуют, тонус мышц значительно снижен, дыхание ровное, замедленное, пульс и артериальное давление на исходном уровне, слизистые оболочки влажные, кожные покровы розовые.
3 уровень - уровень расширения зрачка. Появляются первые признаки передозировки - зрачок расширяется вследствие паралича гладкой мускулатуры радужной оболочки, реакция на свет резко ослаблена, появляется сухость роговицы. Кожные покровы бледные, резко снижается тонус мышц (сохранен только тонус сфинктеров). Реберное дыхание постепенно ослабевает, преобладает диафрагмальное, вдох несколько короче выдоха, пульс учащается, артериальное давление снижается.
4 уровень - уровень диафрагмального дыхания - признак передозировки и предвестник летального исхода. Для него характерно резкое расширение зрачков, отсутствие их реакции на свет, тусклая, сухая роговица, полный паралич дыхательных межреберных мышц; сохранено только диафрагмальное дыхание - поверхностное, аритмичное. Кожные покровы бледные с цианотич-ным оттенком, пульс нитевидный, учащенный, артериальное давление не определяется, возникает паралич сфинктеров.
Четвертая стадия - АГОНАЛЬНАЯ - паралич дыхательного и сосу-додвигательного центров, проявляется остановкой дыхания и сердечной деятельности.
В течение операции глубина общей анестезии не должна превышать 2 уровень хирургической стадии. ПРОБУЖДЕНИЕ больного наступает после прекращения введения общего анестетика и характеризуется постепенным восстановлением рефлексов, тонуса мышц, чувствительности, сознания в обратном порядке, отображая стадии общей анестезии.
Пробуждение происходит медленно и зависит от индивидуальных особенностей больного, длительности и глубины общей анестезии, общего анестетика и продолжается от нескольких минут до нескольких часов.
Все общие анестетики может использовать только медицинский персонал, прошедший подготовку по анестезиологии и интенсивной терапии, и при наличии элементарной дыхательной аппаратуры.
К основным осложнениям общей анестезии относятся: гиповентиляция с развитием гипоксемии и гипоксией, рвота и регургитация желудочного содержимого с последующей аспирацией в дыхательные пути, синдром Мендельсона (токсико-инфекционный пульмонит), ларинго- и бронхиолоспазм, гипотензия, остановка кровообращения, аллергические реакции немедленного типа.
Это свойство имеет большое значение в хирургии и анестезиологии, так как мышечный тонус нередко мешает создавать оптимальные условия для хирургического вмешательства и проведения интубации.
Классификация мышечных релаксантов
Все мышечные релаксанты можно подразделить на деполяризующие и недеполяризующие. Кроме того, с клинической точки зрения целесообразно подразделять миорелаксанты на препараты ультракороткого действия (действуют 5-7 мин), короткого действия (продолжительность действия менее 20 мин), средней продолжительности (менее 40 мин) и миорелаксанты длительного действия (более 40 мин).
К деполяризующим мышечным релаксантам относятся препараты суксаметония - листенон, дитилин, сукцинилхолин. Они же являются миорелаксантами ультракороткого действия и отличаются друг от друга лишь входящей в состав солью.
К недеполяризующим миорелаксантам короткого действия относят мивакуриум. Недеполяризующими миорелаксантами средней продолжительности являются атракуриум, векурониум, рокурониум, цисатракуриум. Представителями недеполяризующих миорелаксантов длительного действия являются пипекуроний, панкурониум, тубокурарин.
Механизм действия деполяризующих миорелаксантов
Структура деполяризующих миорелаксантов сходна с молекулой ацетилхолина. При взаимодействии с Н-холинорецепторами препараты суксаметония вызывают потенциал действия мышечной клетки. Таким образом, подобно ацетилхолину деполяризующие миорелаксанты вызывают деполяризацию и стимуляцию мышечного волокна. Однако ацетилхолинэстераза на препараты суксаметония не действует, вследствие чего их концентрация в синаптической щели возрастает. Это приводит к длительной деполяризации концевой пластины и к миорелаксации.
Разрушение деполяризующих миорелаксантов происходит холинэстеразой плазмы.
Препараты суксаметония
При введении препаратов суксаметония полная нервно-мышечная блокада возникает в течение 30-40 секунд, что позволяет применять их для проведения интубации трахеи. Длительность нейро-мышечного блока - от 4 до 6 минут. Это время может увеличиться при количественной или качественной недостаточности плазменной холинэстеразы. Частота встречаемости недостаточности - 1:3000.
Иногда деполяризующие релаксанты могут вызвать вторую фазу блока - недеполяризующий блок. Тогда действие препаратов суксаметония приобретает непрогнозируемый эффект и длительность.
Побочные эффекты препаратов суксаметония
При использовании препаратов суксаметония следует иметь ввиду их высокий гистаминный эффект.
Побочное действие деполяризующих миорелаксантов на сердечно-сосудистую систему выражается в нарушениях ритма, колебаниях артериального давления и ЧСС. Причём препараты суксаметония чаще вызывают брадикардию.
 Другим побочным эффектом, присущим всем деполяризующим миорелаксантам, являются фасцикуляции, по присутствии которых судят о начале действия препарата. Если появление фасцикуляций нежелательно, то перед введением суксаметония нужно провести прекурарезацию. Так называется метод введения недеполяризующего миорелаксанта (к примеру, 1 мг аркурона) за 5 минут до введения суксаметония для профилактики побочных действия последнего.
Другим побочным эффектом, присущим всем деполяризующим миорелаксантам, являются фасцикуляции, по присутствии которых судят о начале действия препарата. Если появление фасцикуляций нежелательно, то перед введением суксаметония нужно провести прекурарезацию. Так называется метод введения недеполяризующего миорелаксанта (к примеру, 1 мг аркурона) за 5 минут до введения суксаметония для профилактики побочных действия последнего.
Грозным побочным эффектом при применении препаратов суксаметония является гиперкалиемия. Если исходный уровень калия в норме, то этот побочный эффект не имеет клинического значения. При состояниях, сопровождающихся повышением уровня калия в крови (ожогах, обширных травмах, миопатии, столбняке, острой кишечной непроходимости) применение деполяризующих миорелаксантов может представлять угрозу для жизни.
Нередким побочным эффектом препаратов суксаметония являются мышечные боли в послеоперационном периоде.
Повышение давления в полости желудка, вызываемое мышечными релаксантами из группы деполяризующих препаратов, не увеличивает риск возникновения желудочного рефлюкса и лёгочной аспирации.
Сукцинилхолин повышает внутриглазное давление, что может ограничить его применение в офтальмологических операциях в отсутствии проведённой прекураризации.
Ультракороткие миорелаксанты увеличивают мозговой кровоток и внутричерепное давление, что также можно предотвратить прекураризацией.
Деполяризующие миорелаксанты могут вызывать злокачественную гипертермию.
Опасно введение суксаметония при миотонии - это может спровоцировать генерализованные сокращения (миоклонус).
Типичным представителем мышечных релаксантов, наиболее широко используемых в странах СНГ, является дитилин.
Дитилин выпускается в ампулах по 2 мл в виде 2% раствора. При внутривенном введении эффект развивается через 60 секунд и продолжается 5-10 минут, при внутримышечном - расслабление мускулатуры развивается через 2-4 минуты и длится 5-10 минут.
Дитилин с успехом применяется для интубации трахеи, при проведении бронхо- и эзофагоскопии, для кратковременных операций.
Механизм действия недополяризующих миорелаксантов
Молекулы недеполяризующих миорелаксантов конкурируют с молекулой ацецилхолина за право связаться с рецептором. При связывания миорелаксанта с рецептором последний теряет чувствительность к ацетилхолину, постсинаптическая мембрана находится в состоянии поляризации и деполяризации не происходит. Таким образом, недеполяризующие мышечные релаксанты по отношению к холиновым рецепторам можно назвать конкурентными антагонистами.
Недеполяризующие миорелаксанты не разрушаются ни ацетилхолинэстеразой, ни холинэстеразой крови.
Мивакуриум - мышечный релаксант, действующий до 20 минут. Его применение ограничено ввиду относительно частого побочного эффекта - высвобождения гистамина. Кроме того, зависимость его метаболизма от псевдохолинэстеразы не позволяет провести полную декураризацию антихолинэстеразными препаратами.
Появившись на рынке, мивакуриум не оправдал ожиданий производителей, хотя к его применению при определённых условиях всё же приходиться прибегать.
Атракуриум (тракриум) - мышечный релаксант средней продолжительности действия. Выпускается в ампулах по 2,5 и 5 мл. В 1 мл - 10 мг активного вещества.
Тракриум применяется как компонент общей анестезии при интубации трахеи. Особенно полезно его действие при хирургических вмешательствах и для облегчения проведения ИВЛ.
У взрослых тракриум применяют из расчёта 0,3-0,6 мг/кг. При необходимости дополнительного введения миорелаксанта доза должна быть рассчитана в количестве 0,1-0,2 мг/кг.
Детям в возрасте от двух лет атракурий назначается в тех же дозировках, что и взрослым. У детей младше двух лет миорелаксант применяют в расчёте 0,3-0,4 мг/ кг на фоне галотанового наркоза.
Восстановление проводимости после нервно-мышечной блокады, вызванной атракурием, происходит примерно через 35 минут.
Побочными эффектами применения тракриума могут быть:
- преходящее снижение артериального давления;
- гиперемия кожи;
- бронхоспазм;
- очень редко - анафилактические реакции.
Верокурониум - недеполяризующий миорелаксант стероидной структуры. Верокурониум мало влияет на высвобождение гистамина и отличается кардиостабильностью.
Цисатракуриум (нимбекс) , являющийся стереоизомером атракурия, превосходит его по силе в три раза, хотя время наступления эффекта и его длительность примерно такая же, как и у атракурия.
Цисатракурий выпускается в виде ампул по 2,5 и 5 мл по 2 и 5 мг.
Как и для всех миорелаксантов, показаниями к применению цисатракурия служат интубация трахеи, поддержание расслабления мускулатуры, проведение ИВЛ.
Применяется нимбекс для интубации трахеи в дозе 0,15 мг/кг, поддерживающая доза- 0,1 мг/кг.
Рокурониум (эсмерон) - недеполяризующий миорелаксант средней продолжительности действия, положительной чертой которого является быстрота наступления эффекта. Кроме того, минимальное высвобождение гистамина и незначительный кардиоваскулярный эффект сделали рокуроний очень популярным препаратом в анестезиологии.
Эсмерон выпускается во флаконах по 5 мл, 10 мл и 25 мл. В 1 мл содержится 10 мг рокурония бромида.
Доза рокурония для интубации трахеи - 0,3-0,6 мг/кг, поддерживающая доза- 0,15 мг/кг.
Пипекуроний (ардуан, аркурон) относится к недеполяризующим миорелаксантам длительного действия.
Ардуан выпускается в ампулах по 2 мл (1 мл содержит 4 мг пипекурония бромида).
У взрослых пипекуроний применяется из расчёта 0,07-0,08 мг/кг, у детей - 0,08-0,09 мг/кг. Эффект препарата длится в течение 50-70 минут.
Из побочных явлений пипекурония следует отметить брадикардию, гипотонию, редко - анафилактические реакции.
Панкуриной (павулон) - выпускается в ампулах для внутривенного введения по 2 мл (1 мл содержит 2 мг панкурония бромида).
У взрослых и детей от четырёх недель панкуроний применяется в дозе 0,08-0,1 мг/кг. Препарат вызывает хорошую миорелаксацию для проведения интубации трахеи через 90-120 секунд.
Побочные действия со стороны сердечно-сосудистой системы, вызываемые панкуронием - незначительное повышение ЧСС и АД.
Тубокурарин выпускается в виде 1% раствора в ампулах по 1,5 мл.
В настоящее время тубокурарин практически не применяется из-за вызываемой им артериальной гипотонии и тахикардии, что является следствием повышенного высвобождения гистамина.
Начало действия тубокурарина через 60-90 секунд. Для интубации используют дозировку 0,5-0,6 мг/кг.
 Хотите читать всё самое интересное о красоте и здоровье, подпишитесь на рассылку !
Хотите читать всё самое интересное о красоте и здоровье, подпишитесь на рассылку !
ВОЕННО-МЕДИЦИНСКАЯ АКАДЕМИЯ
КАФЕДРА АНЕСТЕЗИОЛОГИИ И РЕАНИМАТОЛОГИИ
“МИОРЕЛАКСАНТЫ, ИХ ПРИМЕНЕНИЕ В АНЕСТЕЗИОЛОГИИ И РЕАНИМАТОЛОГИИ”
Введение
1. Общая характеристика и классификация миорелаксантов по химической структуре и механизму действия
Классификация миорелаксантов по химической структуре
Дериваты стероидов
Атракурий
Таблица 2
Классификация миорелаксантов по механизму
2. Основные сведения о структуре и функции нейромышечного синапса
3. Механизм действия миорелаксантов
4. Влияние миорелаксантов на основные функциональные системы организма и обмен веществ.
5. Показания к применению миорелаксантов в анестезиологии и реаниматологии.
6. Характеристика основных препаратов, методика их применения
7. Контроль за нейромышечной проводимостью
8. Сущность декураризации и методика ее проведения
9. Осложнения, связанные с применением мышечных релаксантов, их профилактика и лечение
10. Перспективы использования миорелаксантов в военно-полевых условиях
Литература:
Преподаватель кафедры анестезиологии и реаниматологии
Введение
Еще в XVI в. стало известно, что южноамериканские индейцы используют для охоты и войны отравленные стрелы, яд которых - кураре - вызывает смерть из-за паралича дыхательных мышц.
После того, как в 1942 г. Гарольд Гриффит опубликовал результаты применения очищенного экстракта кураре во время анестезии, миорелаксанты быстро завоевали достойное место в арсенале анестезиологов и реаниматологов.
Открытие действующего начала кураре тубокурарина оказало огромное влияние на развитие анестезиологии и хирургии и позволило изучить механизм нейро-мышечной передачи.
1. Общая характеристика и классификация миорелаксантов по химической структуре и механизму действия
Миорелаксанты - это препараты, блокирующие нейромышечную передачу. Используются они для проведения контролируемой механической вентиляции легких, создания условий для работы хирургической бригады, особенно при операциях на органах груди и живота, для уменьшения внутричерепной гипертензии, снижения потребления кислорода, устранения дрожи, обеспечения неподвижности при некоторых диагностических манипуляциях, купирования судорожного синдрома и в ряде других случаев.
Все блокаторы нейро-мышечной передачи по своей химической структуре похожи на ацетилхолин. Так, например, сукцинилхолин фактически состоит из 2-х молекул ацетилхолина (слайд). Недеполяризующие релаксанты скрывают свою подобную ацетилхолину структуру в виде кольцевых систем 2-х типов - изохинолиновой и стероидной (слайд). Наличие одного или двух четвертичных атомов азота у всех блокаторов нейро-мышечной передачи делает эти препараты плохо растворимыми в липидах, что предотвращает их попадание в ЦНС.
Все блокаторы нейро-мышечной передачи высокополярны и неактивны при пероральном приеме. Их вводят только внутривенно.
Элиминация препарата осуществляется за счет его разрушения псевдохолинэстеразой (бутирилхолинэстеразой) плазмы крови на холин и сукцинилмонохолин с последующим дальнейшим гидролизом последнего на янтарную кислоту и холин.
Метаболизм препарата нарушается при гипотермии (замедление гидролиза) и при низкой концентрации или наследственном дефекте псевдохолинэстеразы. Недеполяризующие релаксанты проявляют к сукцинилхолину антагонистическое действие. Так даже прекураризация (о чем уже говорилось выше) вынуждает увеличивать дозу сукцинилхолина на 50-100%. Исключение здесь составляет панкуроний. Он усиливает действие сукцинилхолина за счет угнетения активности псевдохолинэстеразы.
Из достаточно большого перечня недеполяризующих релаксантов мы рассмотрим только наиболее часто использующиеся. И начнем мы с представления об идеальном миорелаксанте.
Свойства "идеального" миорелаксанта (слайд):
Высокая активность;
Конкурентный механизм действия;
Избирательность действия на н-холинорецепторы скелетных мышц;
Быстрое начало действия;
Кратковременный блок нервно-мышечной передачи (при однократном введении не более 15 мин);
Отсутствие потенцирования или кумуляции при повторном введении;
Отсутствие побочных эффектов;
Низкая токсичность;
Отсутствие физиологической и токсической активности метаболитов и их быстрое выведение из организма;
Наличие эффективных антагонистов;
Стойкость при хранении;
Рентабельность для промышленного производства.
Таблица 4
Современные миорелаксанты (1)
| Name | Высвобождение гистамина | Вагус | Ганглионарная стимуляция | Форма выпуска | Дозировка | Время развития блока | Продолжительность действия |
Цена |
| Сукцинилхолин | Стим. | Стим. | 20 мг/мл | 1 мг/кг | 30 с | 5-10 мин | $0.36/200 мг | |
| d-тубокурарин | - | Блок. | 3 мг/мл | 0.5 мг/кг | 3 мин | 60-100 мин | $4.51/60 мг | |
| Метокурин | - | - | Блок. | 2 мг/мл | 0.3 мг/кг | 3 мин | 60-120 мин | $20.27/40 мг |
| Панкуроний | - | Блок. | - | 1 мг/мл | 0.1 мг/кг | 3 мин | 60-120 мин | $1.31/10 мг |
| Доксакурий | - | - | - | 1 мг/мл | 0.06 мг/кг | 4 мин | 90-150 мин | $13.49/5 мг |
| Векуроний | - | - | - | 10 мг | 0.1 мг/кг | 2 мин | 45-90 мин | $18.11/10 мг |
| Цисатракурий | - | - | - | 10 мг/мл | 0.5 мг/кг | 2 мин | 30-45 мин | $39.47/100 мг |
| Рокуроний | - | Блок. | - | 10 мг/мл | 1 мг/кг | 1 мин | 45-75 мин | $14.62/50 мг |
| Мивакурий | - | - | 20 мг/мл | 0.2 мг/кг | 1 мин | 15-20 мин | $8.05/100 мг |
Таблица 5
Современные миорелаксанты (2)
| Миорелаксант | Метаболизм | Главный путь элиминации | Начало действия | Длительность действия | Высвобождение гистамина | Блокада блуждающего нерва | Относительная мощность | Относительная стоимость |
| Тубокурарин | Незначительный | Почки | ++ | +++ | +++ | 0 | 1 | Низкая |
| Метокурин | Незначительный | Почки | ++ | +++ | ++ | 0 | 2 | Средняя |
| Атракурий | +++ | Незначительный | ++ | ++ | + | 0 | 1 | Высокая |
| Мивакурий | +++ | Незначительный | ++ | + | + | 0 | 2,5 | Средняя |
| Доксакурий | Незначительный | Почки | + | +++ | 0 | 0 | 12 | Высокая |
| Панкуроний | + | Почки | ++ | +++ | 0 | ++ | 5 | Низкая |
| Пипекуроний | + | Почки | ++ | +++ | 0 | 0 | 6 | Высокая |
| Векуроний | + | Желчь | ++ | ++ | 0 | 0 | 5 | Высокая |
| Рокуроний | Незначительный | Желчь | +++ | ++ | 0 | + | 1 | Высокая |
По данным литературы, наиболее используемыми недеполяризующими миорелаксантами в мире на сегодняшний день являются атракурий и цисатракурий, доксакурий, мивакурий, векуроний, и быстро набирающий популярность рокуроний. В нашей стране по-прежнему широко используются панкуроний (павулон) и пипекуроний (ардуан). В связи с этим более подробно остановимся на основных и побочных эффектах именно этих представителей класса недеполяризующих релаксантов.
Атракурий
Несомненным достоинством препарата является его способность подвергаться спонтанному разрушению в организме за счет двух процессов – гидролиза эфирной связи (катализируется неспецифическими эстеразами без участия ацетилхолин- и псевдохолинэстеразы), и элиминации Хоффмана (спонтанное неферментативное разрушение при физиологических значениях рН и температуры тела). С мочой и желчью выводится не более 10% препарата.
Для интубации трахеи необходима доза 0,5 мг/кг. Эффективный блок развивается через 2,3±1,1 мин (Mellinghoffetal., 1996) или даже через 1,2 мин (Debaene B. etal., 1995). Продолжительность блока при этом составляет 20-30 мин (SharpeM.D., 1992). Нагрузочная доза для интраоперационной миорелаксации – 0,25 мг/кг, поддерживающая – 0,1 мг/кг каждые 10-20 мин, может применяться инфузия 5-9 мкг/кг/мин. BeattieW.S. с соавт. (1992) сообщает об эффективности инфузионной дозы 7,6±1,1 мкг/кг/мин.
Причем даже после длительной инфузии препарата при проведении интенсивной терапии отмечается быстрое спонтанное восстановление нейромышечной проводимости. SharpeM.D. (1992) приводит результаты исследования, в котором после 90-часовой инфузии препарата прекращение блока наступало в среднем через 39 мин, что связано с отсутствием кумуляции на фоне разрушения атракуриума за счет элиминации Хоффмана.
Побочные эффекты препарата (SharpeM.D., 1992; MorganG.E., MikhailM.S., 1996):
Артериальная гипотензия и тахикардия, связанные с высвобождением гистамина, возникают редко, особенно при медленном введении и исключении передозировки. Наблюдаются преимущественно у пожилых пациентов и больных с гиповолемией;
Бронхоспазм может возникать даже без имеющейся в анамнезе бронхиальной астмы;
Возбуждение ЦНС и судороги, связанные с действием метаболита атракуриума – лауданозина, могут наблюдаться при абсолютной или относительной (печеночная недостаточность) передозировке препарата.
Kumar A. A. et al. (1993) описали тяжелый анафилактический шок после введения атракурия, потребовавший больших доз адреналина и длительной сердечно-легочной реанимации.
Необходимо помнить, что гипотермия и ацидоз, затрудняя элиминацию Хоффмана, удлиняют действие препарата (MorganG.E., MikhailM.S., 1996).
Цисатракурий
Этот препарат является изомером атракурия. Он также подвергается элиминации Хоффмана, однако, в отличие от атракурия, не разрушается неспецифическими эстеразами. Печеночная и почечная недостаточность не влияют на метаболизм цисатракурия (PrielippR.C. etal., 1995; DeWolfA.M. etal., 1996; MorganG.E., MikhailM.S., 1996).
Доза для интубации составляет 0,1 – 0,15 мг/кг. Причем при введении соответственно 0,1; 0,15 и 0,2 мг/кг эффективный блок развивается через 4,6; 3,4 и 2,8 мин, а продолжительность его составляет 45; 55 и 61 мин. Интубировать можно соответственно через 2 мин после введения 0,1 мг/кг и через 1,5 мин при введении большей дозы (BluesteinL.S. etal., 1996). По данным Бунянята А.А. с соавт. (1999) и Мизикова В.М. с соавт. (1999) после введения 0,15 мг/кг препарата хорошие условия для интубации трахеи возникают через 3 мин.
Для поддержания релаксации используется инфузия со скоростью 1-2 мкг/кг/мин (MorganG.E., MikhailM.S., 1996) или повторные болюсные дозы 0,03 мг/кг (Бунятян А.А. с соавт., 1999; Мизиков В.М. с соавт., 1999). Повторные болюсные дозы обеспечивают клинически эффективную миоплегию в течение 18-26 мин, а продолжительность 95%-го блока после первоначальной дозы 0,15 мг/кг составила, в среднем, 54±10 мин (Бунятян А.А. с соавт., 1999).
Mellinghoff H. et al. (1996) в качестве первоначальной дозы использовали 0,1 мг/кг цисатракуриума. Эффект развивался через 3,1±1,0 мин. Для поддержания 95%-ного блока требовалась инфузия препарата со скоростью 1,5±0,4 мкг/кг/мин. После прекращения инфузии спонтанное время восстановления от 25% до 75% TOF составило 18±11 мин, при проведении декураризации - 5±2 мин.
В отличие от атракурия препарат не вызывает повышения уровня гистамина в плазме и, соответственно, не влияет на ЧСС, АД и вегетативную нервную систему. Не отмечено также кожных аллергических реакций и бронхоспазма (LepageJ.-Y. etal., 1996; Бунятян А.А. с соавт., 1999; Мизиков В.М. с соавт., 1999).
Токсичность лауданозина, образующегося при элиминации Хоффмана, и чувствительность к температуре и рН аналогичны таковым у атракуриума (DeWolfA.M. etal., 1996; MorganG.E., MikhailM.S., 1996).
К преимуществу цисатракурия по сревнению с векуронием и рокуронием является его дозонезависимая скорость прекращение блока. Преимущество по сравнению с атракурием сводится практически только к явно меньшей либерации гистамина и трехкратному преимуществу по силе действия (PrielippR.C. etal., 1995; BluesteinL.S. etal., 1996; DeWolfA.M. etal., 1996). Восстановление после длительной инфузии цисатракурия происходит быстрее, нежели после аналогичного введения векурония (PrielippR.C. etal., 1995).
Таким образом, как отмечает большинство исследователей, цисатракурий является сильным недеполяризующим миорелаксантом средней продолжительности действия, характеризующийся отсутствием влияния на кровообращение и не вызывающий высвобождения гистамина, что позволяет использовать его у пациентов с высоким операционно-анестезиологическим риском.
Мивакурий
Отличительной особенностью данного препарата является его гидролиз, подобно сукцинилхолину, с помощью псевдохолинэстеразы. Хотя при наличии даже минимально восстановленного мышечного тонуса эффективны в плане декураризации антихолинэстеразные препараты. При печеночной и почечной (?) недостаточности снижается концентрация холинэстеразы, увеличивая тем самым продолжительность действия мивакрона.
Для проведения интубации трахеи необходима доза 0,15-0,2 мг/кг. В дальнейшем рекомендуется поддерживать миорелаксацию инфузией со скоростью 4-10 мкг/кг/мин или дробным введением по 0,1-0,15 мг/кг. Полный мышечный блок после введения интубационной дозы развивается через 1,5-2,2 мин, продолжительность блока при этом составляет 10-12 мин (Башев Н.Н. с соавт., 1998). По другим данным, начало действия препарата – 2-3 мин, а продолжительность блока составляет около 20 мин (SharpeM.D., 1992; MorganG.E., MikhailM.S., 1996; Гриненко, Т.Ф. с соавт., 1998).
Мивакурий способен вызывать либерацию гистамина, что может проявляться артериальной гипотензией и тахикардией. Поэтому рекомендуют в премедикацию включать антигистаминные препараты (Башев Н.Н. с соавт., 1998). Хотя по данным Ровиной А.К. с соавт. (1998), выраженные изменения гемодинамики, гистаминогенные осложнения при применении мивакурия отсутствовали. SharpeM.D. (1992) указывает, что гипотензия развивается чаще при введении дозы, выше, чем 0,15 мг/кг, или при быстром болюсном введении препарата (быстрее, чем за 60 с).
Мивакурий снижает внутриглазное давление, поэтому рекомендуется для внутриглазных операций (Малоярославцев В.Д. с соавт., 1998).
В целом, мивакрон считается препаратом выбора при коротких операциях, особенно в стационаре одного дня (Гриненко Т.Ф. с соавт., 1998).
Доксакурий
Частично гидролизуется псевдохолинэстеразой. Основной же путь элиминации – выделение почками (до 40%) и с желчью (Sharpe M.D., 1992; Morgan G.E., Mikhail M.S., 1996). Поэтому его эффект продлевается при печеночной и/или почечной недостаточности.
Для проведения интубации необходима доза 0,05 мг/кг. При этом приемлемые условия создаются через 5 (MorganG.E., MikhailM.S., 1996) или 6 мин (SharpeM.D., 1992), при этом средняя продолжительность блока – 83 мин (60-90 мин) – наибольшая среди всех миорелаксантов. Нагрузочная доза для интраоперационной миорелаксации 0,02 мг/кг, для поддержания достаточно вводить препарат дробно по 0,005 мг/кг.
Доксакурий не высвобождает гистамин и поэтому не влияет на кровообращение.
В связи с невыраженными побочными эффектами и большой продолжительностью действия считается наиболее удобным для длительной релаксации при проведении интенсивной терапии (SharpeM.D., 1992).
Панкуроний (павулон)
В определенной степени подвергается деацетилированию в печени, кроме того, основная часть препарата выводится почками. Поэтому печеночная и почечная недостаточность влияют на фармакокинетику препарата.
Для интубации трахеи требуется доза 0,08-0,12 мг/кг. Удовлетворительные условия для интубации возникают через 2-3 мин. Нагрузочная доза для миорелаксации – 0,04 мг/кг, поддерживающая доза 0,01 мг/кг каждые 20-40 мин (MorganG.E., MikhailM.S., 1996). По SharpeM.D. (1992), после введения 0,1 мг/кг препарата удовлетворительные условия для интубации трахеи возникают через 90-120 с. При этом блок длится до 60 мин. Для проведения продленной миоплегии рекомендуется использовать инфузию 0,02-0,04 мг/кг/ч.
Почечная, печеночная недостаточность, цирроз печени, нарушение оттока желчи удлиняют действие препарата (вплоть до двухкратного). Поэтому следует осторожно применять его в интенсивной терапии, где возможно существенная пролонгация нейромышечного блока (SharpeM.D., 1992). Для продленной миоплегии в интенсивной терапии Khuenl-Brady K.S. с соавт. (1994) рекомендует среднюю дозу 3 мг/ч.
Отличительной особенностью препарата является его способность блокировать влияние вагуса и высвобождать катехоламины из адренергических нервных окончаний, а также ингибировать реаптейк норадреналина. В связи с этим побочными эффектами препарата являются тахикардия, умеренная гипертензия, аритмии, повышение потребности миокарда в кислороде (SharpeM.D., 1992; MorganG.E., MikhailM.S., 1996).
В целом, препарат имеет достаточно неприятные побочные эффекты, при печеночно-почечной недостаточности действие его может существенно удлиняться, но среди всех недеполяризующих релаксантов среднего и длительного действия – это самый дешевый препарат.
Векуроний
Очень близок по химической структуре к панкуронию, в связи с чем значительно менее выражены побочные эффекты.
В небольшой степени метаболизируется в печени, выделяется с желчью и почками. Векуроний равноэффективен панкуронию, вводится в аналогичных дозах. При введении 0,1 мг/кг через 90-120 с создавались идеальные условия для интубации. Длительность действия препарат при этом составляла от 20-25 мин (Налапко Ю.И., 1998) до 45 мин (SharpeM.D., 1992).
Применение его в начальной дозе 0,4 мг/кг сокращало время до развития блока до 78 с без проявления каких-либо гемодинамических эффектов. Применение дозы 0,5 мг/кг вызывало развитие блока, сходное по быстроте с сукцинилхолином. Поэтому SharpeM.D. (1992) заключает, что у больных, которым противопоказан сукцинилхолин, векуроний в дозе 0,4-0,5 мг/кг является альтернативой для проведения интубации трахеи. Однако при этом средняя продолжительность блока составляет 115 мин.
HuemerG. с соавт. (1995) рекомендует для ускорения развития блока вводить сначала 0,01 мг/кг, затем через 4 мин 0,05 мг/кг. При этом спустя 1-2 мин после введения второй дозы возникают хорошие условия для интубации трахеи. Продолжительность блока при этом небольшая, что важно для амбулаторной анестезиологии.
Приращиваемая болюсная доза 0,03 мг/кг, продолжительность ее действия 25-30 мин (Бабаева Н.П., 1998). Возможна инфузия в дозе 1-2 мкг/кг/мин (MorganG.E., MikhailM.S., 1996) или 0,1-0,2 мг/кг/ч (SharpeM.D., 1992). Однако последнее относится преимущественно к операциям, поскольку при проведении интенсивной терапии либо могут потребоваться большие дозы, либо (при наличии почечной или печеночной недостаточности, холестаза) блок может быть значительно пролонгирован (SharpeM.D., 1992). Во всяком случае, в литературе нет единого мнения по поводу целесообразности применения векурония для миоплегии в интенсивной терапии, хотя в этом смысле привлекает практически полное отсутствие у него побочных эффектов.
BeattieW.S. с соавт. (1992) отмечает, что при необходимой продолжительности блока до 30 мин, следует инфузировать препарат со скоростью 1,01±0,16 мкг/кг/мин, при блоке до 60 мин – 0,89±0,12 мкг/кг/мин, а при блоке 90 и более мин – 0,85±0,17 мкг/кг/мин (в среднем, 0,94±0,23 мкг/кг/мин). Подобное уменьшение скорости инфузии для поддержания достаточной релаксации (что свидетельствует о кумуляции) отметил и Martineau R.J. с соавт. (1992). В его исследовании скорость инфузии оказалось возможным уменьшить до 0,47±0,13 мкг/кг/мин.
Длительность действия препарата в целом несколько короче, чем у панкурония, за счет более быстрой элиминации. Влияния на кровообращение не оказывает, поскольку не имеет ганглиоблокирующего эффекта, не высвобождает гистамин. Поэтому рекомендуется для применения у больных с высоким анестезиологическим риском (Бабаева Н.П., 1998), а также в военно-полевой анестезиологии и медицине катастроф (Бакеев Р.Ф., 1998). В последнем случае особую важность приобретают небольшая продолжительность действия, быстрое восстановление мышечного тонуса и спонтанного дыхания, отсутствие кумуляции при повторном введении, что позволяет увеличить пропускную способность этапа медицинской эвакуации, обеспечить, при необходимости, немедленную эвакуацию раненых.
В связи с быстрым восстановлением мышечного тонуса, не требующим применения антихолинэстеразных средств, рекомендуется для применения при торакальных операциях (Кузнецова О.Ю. с соавт., 1998), при лапароскопических холецистэктомиях (Налапко Ю.И., 1998).
Препарат считают оптимальным с позиций критерия стоимость/эффективность при средней продолжительности и длительных операциях (Гриненко Т.Ф. с соавт., 1998).
Пипекуроний (ардуан)
Также очень похож по структуре на панкуроний. Метаболизм незначителен. Элиминация определяется экскрецией через почки (70%) и с желчью (20%). Препарат немного мощнее панкурония. Доза для интубации 0,06-0,1 мг/кг. Дозы для поддержания на 20% меньше, чем у панкурония. Препарат не вызывает высвобождение гистамина и не влияет на кровообращение (MorganG.E., MikhailM.S., 1996). При введении 0,07 мг/кг оптимальные условия для интубации возникают через 3 мин, а клинически эффективный блок длится 70 мин (SharpeM.D., 1992).
Так же, как и для панкурония, для продленной миоплегии в интенсивной терапии рекомендуется средняя доза 3 мг/ч (Khuenl-Brady K.S. etal., 1994).
Рокуроний
Не подвергается метаболизму и элиминируется в основном с желчью, меньше через почки. Причем, по данным Суслова В.В. с соавт (1998), фармакодинамические характеристики препарата не зависят от степени почечной недостаточности. Мощность препарата значительно ниже, чем у других релаксантов, в частности, соотношение его силы по сравнению с атракуриумом и векурониумом выглядит как 1: 1,2: 8,5 (BartkowskiR.R. etal., 1993). Для проведения интубации необходимо ввести 0,45-0,6 мг/кг препарата. После введения 0,6 мг/кг через 90 с создаются хорошие или отличные условия для интубации (MarenovicT., MarkovichM., 1998). А PuuhringerF.K. с соавт. (1992) отмечал приемлемые условия для интубации трахеи уже через 60 с после применения указанной дозы препарата. Для поддержания рокуроний вводят по 0,15 мг/кг.
Рокуроний в дозе 0,9-1,2 мг/кг начинает действовать практически так же быстро, как сукцинилхолин. Поэтому он удобен для интубации трахеи. Длительность действия и время восстановления после интубационной дозы сходна с таковой у векурония и атракурия, кумуляции не наблюдалось на протяжении 7 последовательных введений, не влияет на гемодинамику и не высвобождает гистамин, дает достаточно выраженный ваголитический эффект. Поэтому препарат приближается к "идеальному" релаксанту (MarenovicT., MarkovichM., 1998; Суслов В.В. с соавт, 1998), и его считают наиболее предпочтительным при операциях у больных пожилого и старческого возраста (Суслов В.В. с соавт, 1998), пациентов c высоким анестезиологическим риском (McCoyE.P. etal., 1993).
Сравнительная оценка препаратов
J. Viby-Mogensen (1998) считает, что экономически более выгодно применять более дорогие релаксанты средней и короткой продолжительности действия (векуроний, атракурий) по сравнению с дешевыми но длительно действующими препаратами (панкуроний, тубокурарин), поскольку это значительно (в 4 раза) уменьшает частоту остаточной кураризации и послеоперационных легочных осложнений.
BeattieW.S. с соавт. (1992), сравнивая атракурий и векуроний, отмечают, что на прогнозирование времени окончания блока в первом случае влияет только возраст, в случае же векурония, кроме возраста следует учитывать и продолжительность поддерживающей инфузии. В этой же работе указывается, что 19% анестезиологической смертности приходится на острую дыхательную недостаточность в постнаркозном периоде, вызванную остаточным действием релаксантов. До 42% больных поступают в палату пробуждения с признаками неполного восстановления нейромышечной проводимости. Применение же таких препаратов, как атракурий и векуроний (в отличие от, например, панкурония), позволяет снизить частоту осложнений, поскольку время восстановления нейромышечной проводимости до 85%-ного уровня (на фоне декураризации неостигмином) при их использовании в виде инфузии составляет у большинства больных менее 20 мин.
Влияние некоторых параметров гомеостаза на фармакологию миорелаксантов. Гипотермия удлиняет блок за счет угнетения метаболизма и замедления экскреции. Потенцируют действие недеполяризующих миорелаксантов респираторный ацидоз, гипокальциемия, гипокалиемия, гипермагниемия. Печеночная и почечная недостаточность увеличивают объем внеклеточной жидкости и соответственно объем распределения и, тем самым, уменьшают концентрацию препаратов в плазме. В то же время, за счет замедленной элиминации препаратов их продолжительность действия увеличивается. Поэтому рекомендуется использовать большую нагрузочную, но меньшие поддерживающие дозы.
Таблица 6
Взаимодействие миорелаксантов с другими лекарственными средствами (потенцирование "+" и угнетение "–" нейромышечного блока)
7. Контроль за нейромышечной проводимостью
Для наиболее успешного применения миорелаксантов целесообразно использовать мониторинг нейромышечной проводимости.
Он может быть в варианте механомиографии, электромиографии (наиболее приемлема для научных целей), акцелеромиографии (наиболее удобен в клинической практике).
При этом возможны следующие паттерны стимуляции (слайд):
Стимуляция одним импульсом (0,1-1 Гц);
Стимуляция серией из 4-х импульсов (2 Гц с интервалом 15 с);
Тетаническая стимуляция (30,50 или 100Гц);
Посттетаническая стимуляция (50 Гц в течение 5 с, пауза 3 с, затем импульсы с частотой 1 Гц с подсчетом ответов мышцы);
Стимуляция "2 вспышки" (2 "вспышки" тетанической стимуляции 50 Гц).
Для стимуляции используются наиболее часто локтевой нерв (мышца, отводящая большой палец) или лицевой нерв (круговая мышца глаза).
Нейромышечный мониторинг позволяет оценивать время интубации трахеи (ориентировочно), развитие максимального блока, контролировать его глубину по ходу анестезии (при проведении интенсивной терапии), определять возможность экстубации (наряду с клиническими признаками).
8. Сущность декураризации и методика ее проведения
Зачастую возникает необходимость ускорить восстановление нейромышечной проводимости по окончании общей анестезии. Искусственное прекращение действия недеполяризующих миорелаксантов называется декураризацией.
Ее рекомендуется проводить при наличии хотя бы минимально восстановленного мышечного тонуса. При наличии монитора нейромышечной проводимости это соответствует 10% и более от ее исходного уровня. В противном случае риск рекураризации (то есть возобновления действия миорелаксанта высок) чрезвычайно высок.
Для декураризации используются ингибиторы ацетилхолинэстеразы, приводящие к накоплению в синапсе ацетилхолина, его конкуренции с недеполяризующим релаксантом и облегчению нейромышечной проводимости. Кроме того, неостигмин и его аналоги способствуют облегчению высвобождения ацетилхолина нервными окончаниями.
Механизм действия ингибиторов ацетилхолинэстеразы сводится к следующему. Препарат связывается с активным центром фермента, блокирует его, не давая возможность реагировать с ацетилхолином. Причем сам антихолинэстеразный препарат при этом подвергается гидролизу, аналогичному происходящему с ацетилхолином. Только если при взаимодействии с ферментом самого ацетилхолина гидролиз завершается за период около 150 мкс, то реакция с эдрофониумом продолжается от 2 до 10 мин, а неостигмин и аналоги (за счет двухэтапности процесса) находятся в ковалентной связи с ферментом от 30 мин до 6 ч.
Учитывая развивающийся при введении антихолинэстеразных препаратов выраженный м-холиномиметический эффект (брадикардия, саливация, бронхорея, ларингоспазм), необходимо предварять их введение инъекцией атропина (порядка 0,01 мг/кг).
Неостигмин и его аналоги (прозерин) вводится в дозе 40-80 мкг/кг (но не более 5 мг) под контролем частоты сердечных сокращений. При необходимости повторяют инъекцию атропина. При недостаточном эффекте допускается повторное введение анихолинэстеразных препаратов (суммарная доза неостигмина, тем не менее, не должна превышать 5 мг, т.е. 10мл. 0,05% р-ра). Эффект развивается через 5-10 мин после инъекции.
Эдрофоний вводится в дозе 0,5-1 мг/кг. При этом его эффект развивается быстрее – спустя 1-2 мин, но и продолжается значительно меньше, чем у неостигмина.
9. Осложнения, связанные с применением мышечных релаксантов, их профилактика и лечение
Как и при использовании любых других препаратов при применении миорелаксантов возможны различные осложнения. Большинство из них связаны с основным и побочными действиями самих релаксантов, поэтому частота их невелика при грамотном использовании.
Естественно, возможны аллергические реакции вплоть до анафилактических. Диагностика и лечение их проводится по общепринятым правилам, поэтому позвольте на них не останавливаться.
Наиболее часто встречаются мышечные боли после применения сукцинилхолина (ранее уже говорилось, что их отмечают до 90% больных). Профилактика заключается в проведении прекураризации, т.е. введении за несколько минут до инъекции сукцинилхолина приблизительно ¼ расчетной дозы недеполяризующего миорелаксанта, хотя эта мера не всегда эффективна. Альтернативой прекураризации является внутривенное введение также за несколько минут до сукцинилхолина 60-120 мг лидокаина.
Достаточно часто наблюдаются эффекты, связанные с высвобождением гистамина и ганглионарной блокадой в виде нарушений ритма сердца и артериальной гипотонией. К резкой брадикардии и даже остановке сердца может привести гиперкалиемия в ответ на введение деполяризующих миорелаксантов при тяжелой травме, ожогах и в других ситуациях, о которых говорилось выше.
Длительное остаточное действие миорелаксантов при гиповолемии, нарушениях кровообращения, электролитных расстройствах и ацидозе может приводить к продленному апноэ. Если использовалась декураризация, то при прекращении действия антихолинэстеразных средств возможно возобновление достаточно выраженного нейромышечного блока, называемое рекураризацией. Профилактике данного осложнения способствует внимательный контроль за больным, применение декураризации только после появления отчетливых признаков восстановления мышечного тонуса (желательно использовать нейромышечный мониторинг). Если же рекураризация все же развилась, необходимо, либо выполнить повторную декураризацию, либо произвести реинтубацию трахеи и перевести больного на вспомогательную или искусственную вентиляцию легких.
Как уже указывалось ранее, при использовании миорелаксантов, особенно у больных с "полным" желудком, возможны регургитация и аспирация желудочного содержимого в трахеобронхиальное дерево. С целью профилактики рекомендуется опорожнить желудок с помощью зонда, выполнить прием Селлика, обеспечить возвышенное положение головы и туловища. Кроме того, рекомендуют в премедикации использовать препараты, уменьшающие желудочную секрецию (например, блокаторы H 2 -гистаминовых рецепторов).
Однако более подробно хотелось бы остановиться на синдроме злокачественной гипертермии, редком, но чрезвычайно опасном осложнении с высокой летальностью.
Злокачественная гипертермия – самое опасное осложнение, встречаемое при использовании сукцинилхолина. Оно проявляется в виде гиперметаболического ответа на пусковое воздействие некоторых лекарственных средств или стресса.
Фатальные пирогенные реакции во время анестезии не находили объяснения, пока в 1963 г. в Австралии М. Денборо (M. Denborough) не описал синдром злокачественной гипертермии. Это осложнение встречается достаточно редко (по разным данным, порядка 1:100000 анестезий). Однако в некоторых местностях (например, Канада) бывает значительно чаще (до 1:1500) в связи с семейной природой состояния. Наиболее часто встречается у лиц от 3 до 30 лет. У мужчин распространено более часто, учитывая их большую мышечную массу. Летальность превышает 70%, однако может быть значительно снижена при своевременной диагностике. Специфическое лечение дантроленом с 1979 г. позволило повысить выживаемость до 90%.
Синдром может развиться как во время вводной анестезии, так и спустя несколько часов после ее окончания. Самые частые триггеры – сукцинилхолин и галотан, хотя ими могут быть и другие препараты (калипсол, лидокаин и проч.). Злокачественная гипертермия может усиливаться адреналином, сердечными гликозидами, солями кальция, дериватами теофиллина. Она может возникать и без применения каких-либо лекарств, в ответ на эмоциональную реакцию (предполагается участие эндогенного норадреналина).
Злокачественная гипертермия – функциональные нарушения обмена кальция при патологических отклонения в физиологии мышц, хотя повреждаются при этом и другие структуры, связанные с кальцием (миокард, нервы, тромбоциты, лимфоциты и др.).
Клинические признаки злокачественной гипертермии во время общей анестезии (слайд):
Клинические:
Тахикардия;
Тахипноэ;
Нестабильность АД;
Нарушения ритма сердца;
Влажность кожи;
Лихорадка (повышение tº на 2º в час или tº>42,2ºС);
Фасцикуляции;
Генерализованная ригидность;
Спазм жевательной мускулатуры;
Изменение окраски мочи;
Темная кровь в ране.
Патофизиологические:
Центральная венозная десатурация;
Центральная венозная гиперкапния;
Артериальная гиперкапния;
Метаболический ацидоз;
Респираторный ацидоз;
Гиперкалиемия;
Миоглобинемия;
Миоглобинурия;
Повышение КФК.
Дифференциальный диагноз следует проводить (помимо неадекватности анестезии) с гипертиреозом и феохромоцитомой.
Для выявления "группы риска" используют сбор анемнеза, а также предложены исследование уровня КФК, выявление аномалий строения миофибрилл (особенно вариации их диаметра), биопсия мышц с пробой invitro на галотан и кофеин (самый точный метод).
Лечение злокачественной гипертермии (слайд)
1. Прекратить операцию и анестезию.
2. Прекратить введение газообразных анестетиков.
3. Гипервентиляция 100% кислородом.
4. Дантролен 2,5 мг/кг в/в с последующей инфузией до общей дозы 10 мг/кг.
5. Мониторинг ЭКГ, температуры тела, мочи, АД, ЦВД, конечно-выдыхаемого СО 2, SatO 2 .
6. Охладить больного (в/в ледяной раствор кристаллоидов 15 мл/кг, 3 раза; лед на поверхность тела, промывание желудка и полостей ледяными растворами; экстракорпоральная циркуляция крови) – остановиться при температуре менее 38,3ºС.
7. Купировать нарушения ритма (прокаинамид, в/в 15 мг/кг за 10 мин).
8. Коррекция ацидоза (гидрокарбонат натрия 1-2 ммоль/л первоначально, далее под контролем анализов крови).
9. Поддержание диуреза выше 2 мл/кг/ч (маннитол 0,125 г/кг, лазикс 1мг/кг, повторить до 4 раз, если будет необходимость).
10. Купирование гиперкалиемии (глюкоза с инсулином).
11. В послеоперационном периоде:
Дантролен перорально или в/в 1-3 дня,
Мониторинг продолжить 48 ч,
Провести семейное исследование.
Наиболее перспективными для использования в военно-полевых условиях являются препараты, не вызывающие серьезных побочных эффектов и имеющие управляемое, желательно, средней продолжительности действие. К таким миорелаксантам относятся векуроний (норкурон) и рокурониум (эсмерон). Особенно предпочтителен последний в связи с его уникально быстрым началом действия, мало уступающим сукцинилхолину. Естественно, невозможно будет отказаться от применения собственно сукцинилхолина в ситуациях требующих максимально быстрого обеспечения надежной проходимости верхних дыхательных путей.
К сожалению, следует отметить, что ни один из этих препаратов не производится в России, что делает их применение в условиях широкомасштабных боевых действий затруднительным.
Табельными препаратами в настоящее время являются
Дитилин,
Диплацин.
Заключение: на сегодняшний день анестезиология и реаниматология немыслима без использования миорелаксантов. Обязанность каждого специалиста нашего профиля знать современные миорелаксанты и уметь применять их в повседневной практической работе.
Литература:
1. Катцунг Б.Г. Базисная и клиническая фармакология: Пер. с англ.- М.; СПб., 1998.- Т.1.- 611 с.
2. Морган Д.Э., Михаил М.С. Клиническая анестезиология: Пер. с англ.- М.; СПб., 1998.- 430 с.
3. Левшанков А.И., Сомов С.В. Сравнительная оценка современных миорелаксантов: Отчет о науч.-иссл. работе № 4.99.276п.12.- СПб.: ВМедА, 2000 (в печати).
4. Фармакология миорелаксантов.- М.: Медицина, 1989.- 288 с.
5. Bevan D.R., Bevan J.C., Donati F. Muscle relaxants in clinical anesthesia.- Chicago; London, 1988.- 443 p.
Гриффит проводил первую анестезию с релаксацией 20-летнему водопроводчику, оперировавшемуся по поводу острого аппендицита.
В показания для применения дитилина надо добавить низкую квалификацию анестезиолога (в плане интубации трахеи).
МЫШЕЧНЫЕ РЕЛАКСАНТЫ – это препараты, которые расслабляют поперечно-полосатую мускулатуру. Различают релаксанты центрального и периферического действия. К релаксантам центрального действия относятся транквилизаторы, но их миорелаксирующий эффект связан не с периферическим курареподобным действием, а с влиянием на ЦНС. Мышечные релаксанты периферического действия в связи с особенностями влияния на процесс синаптической передачи подразделяются на две группы.
1.Недеполяризующие миорелаксанты .
К ним относятся тракриум, павулон, ардуан, норкурон, нимбекс. Они парализуют нервно-мышечную передачу вследствие того, что уменьшают чувствительность Н-холинорецепторов синаптической области к ацетилхолину и тем самым исключают возможность деполяризации концевой пластинки и возбуждения мышечного волокна. Соединения этой группы являются истинными курареподобными веществами. Фармакологическими антагонистами этих соединений являются антихолинэстеразные вещества (прозерин, галантамин): угнетая активность холинэстеразы, они приводят к накоплению в области синапсов ацетилхолина, который с повышением концентрации ослабляет взаимодействие курареподобных веществ с Н-холинорецепторами и восстанавливает нервно-мышечную передачу.
2.Деполяризующие миорелаксанты вызывают мышечное расслабление, оказывая холиномиметическое действие, сопровождающееся стойкой деполяризацией, что также нарушает проведение возбуждения с нерва на мышцу. Препараты этой группы быстро гидролизуются холинэстеразой; антихолинэстеразные препараты усиливают их действие. Представителем этой группы является сукцинилхолин (дитилин, листенон).
В зависимости от длительности вызываемого нервно-мышечного блока, миорелаксанты подразделяются на 3 группы:
А) вызывающие быстро развивающуюся нервно-мышечную блокаду (в течение 1 мин), но с коротким периодом действия (до 15 мин) – сукцинилхолин.
В) вызывающие быстро развивающуюся нервно-мышечную блокаду со средней продолжительностью действия (15-30 мин) – норкурон, тракриум, нимбекс.
С) вызывающие нервно-мышечную блокаду с длительным периодом действия (30-150 мин) – ардуан,павулон.
Миорелаксанты должны применяться только при выключенном сознании больного.
Дитилин. Вводят внутривенно. Для интубации и для полного расслабления скелетных и дыхательных мышц во время операции вводят препарат в дозе 1,5 - 2 мг/кг. Для длительного расслабления мускулатуры в течение всей операции можно вводить препарат фракционно через 5 - 7 мин по 0,5 - 1 мг/кг. Повторные дозы дитилина действуют более продолжительно. Осложнений при применении дитилина обычно не наблюдается. Дитилин противопоказан детям грудного возраста и при глаукоме. С осторожностью следует применять дитилин при тяжелых заболеваниях печени, анемии, кахексии, при беременности (препарат проходит через плацентарный барьер). Фармакологические свойства дитилина позволяют применять его у больных миастенией.
Ардуан. Применяют для релаксации мышц при хирургических вмешательствах разного типа, в том числе при операциях на сердце, а также при акушерско-гинекологических операциях. Вводят ардуан внутривенно. Доза для интубации составляет 0,04 - 0,08 мг/кг. При дозе 0,08 мг/кг оптимальные условия для интубации наступают через 2 -3 мин. Для мышечной релаксации при наркозе применяют препарат в дозах от 0,02 до 0,08 мг/кг (чаще 0,04 - 0,05 мг/кг). При этих дозах наступает полная релаксация длительностью около 50 мин. При необходимости удлинения эффекта применяют 1/4 часть начальной дозы. При недостаточной функции почек не следует вводить более 0,04 мг/кг. Применять ардуан можно при разных видах наркоза (фторотаном, эфиром, закисью азота и др.) обязательно при эндотрахеальной интубации больного.
Тракриум . Режим дозирования: Взрослым и детям старше 1 мес для расслабления скелетной мускулатуры Тракриум вводят в/в струйно в дозе 300-600 мкг/кг. Показания: Релаксация скелетной мускулатуры для проведения эндотрахеальной интубации при общей анестезии, хирургических операциях, ИВЛ. Противопоказания: Гиперчувствительность. Применение при беременности и кормлении грудью: возможно, если ожидаемый эффект терапии превышает потенциальный риск для плода. Может быть применен при кесаревом сечении.
Клинический выбор миорелаксанта осуществляется на основании определения необходимой продолжительности нейромышечной блокады с учетом имеющихся побочных эффектов.
Appropriate use of muscle relaxants in anaesthesia, intensive and emergency care
Leo H.D.J. Booij. MD., PhD., FRCA., Professor of Anaesthesiology, Radboud University Medical Centre Nijmegen, P.O. Box 9101, 6400HB, Nijmegen, The Netherlands
Radboud University Medical Centre Nijmegen, P.O. Box 9101, 6400HB, Nijmegen, The Netherlands
Внедрение Griffith и Johnson миорелаксантов в клиническую анестезиологию в 1942 г. в значительной степени изменило практику анестезии и расширило возможности хирургии. В настоящее время мышечная релаксация является неотъемлемой частью анестезиологии, интенсивной терапии и неотложной медицины. Миорелаксанты используются при эндотрахеальной интубации, оперативных вмешательствах и иммобилизации пациентов. При соответствующем применении данные средства обеспечивают безопасность больных, однако их неправильное использование ведёт к повышению инвалидизации и летальности. В связи с этим знание фармакологии мышечных релаксантов очень важно для клиницистов, использующих лекарственные средства данного типа при лечении больных.
1. Нервно-мышечная передача
Передача импульсов с нерва на скелетную мышцу осуществляется через синапсы и опосредована ацетилхолином, который образуется в митохондриях нервных клеток и хранится в пресинаптических пузырьках. В ответ на стимуляцию нерва открываются быстрые натриевые каналы, что вызывает деполяризацию клеточной мембраны нейрона. Это приводит к мобилизации пузырьков, содержащих ацетилхолин, и перемещению их к пресинаптической мембране, где они достигают активной зоны. Количество везикул и, соответственно, количество мобилизованного ацетилхолина зависит от частоты стимуляции нерва. Затем мембраны везикул за счёт взаимодействия белков (v-snare и t-snare) связываются с клеточной стенкой, и их мембраны сливаются с клеточной мембраной нейрона. Процесс мобилизации, связывания и слияния пузырьков называют «транспортм пузырьков» или экзоцитозом. Таким образом, в результате слияния мембран ацетилхолин высвобождается в синаптическую щель и затем диффундирует через неё, достигая постсинаптической мембраны, где связывается с ацетилхолиновыми рецепторами. Связывание активирует рецептор, открывается его ионный канал, вызывая деполяризацию мембраны мышечных клеток. Деполяризация приводит к открытию потенциалозависимых кальциевых каналов L-типа (дигидропиридиновых рецепторов) в мембране Т-трубочек. Конформационные изменения кальциевых каналов L-типа, обусловленные деполяризацией, обеспечивают возможность проникновения ионов кальция в саркоплазму скелетной мышцы, а также вызывают конформационные изменения расположенного поблизости ионного канала, высвобождающего кальций из клетки (рианодинового рецептора), расположенного в мембране саркоплазматического ретикулума миоцита. Это приводит к быстрому поступлению кальция внутрь клетки, где он связывается с тропонином C на актиновых миофиламентах и индуцирует образование мостиков между отдельными филаментами - процесс, ответственный за сокращение мышцы . Затем ацетилхолин диссоциирует от рецептора, и может происходить реполяризация мембраны, за которой следует деполяризация. Ацетилхолин частично метаболизируется ацетилхолинэстеразой в синаптической щели, частично опять поступает в пресинаптическое нервное окончание (рециклинг). Мембрана пузырьков также подвержена рециклингу и используется для продукции новых пузырьков. Этот процесс повторного использования носит название эндоцитоза . Многие лекарственные препараты и токсины (яды змей и т.д.) взаимодействуют с процессом транспорта пузырьков и вызывают паралич или мышечную слабость. Повторно используемый и вновь синтезированный ацетилхолин собирается в пузырьки. На процессы мобилизации пузырьков с ацетилхолином влияют пресинаптические ацетилхолиновые рецепторы. При усилении мышечной активности количество высвобождаемого ацетилхолина снижается; при снижении активности высвобождение ацетилхолина и стимуляция образования рецепторов возрастают. Связывание с этими рецепторами антидеполяризующих релаксантов приводит к снижению ответа на четырехразрядную стимуляцию или тетаническую стимуляцию. Отдельные составляющие постсинаптических ацетилхолиновых рецепторов продуцируются в мышечных клетках, их сборка происходит под воздействием пептидов, высвобождаемых из нервных окончаний вместе с ацетилхолином. В условиях отсутствия высвобождения ацетилхолина в нервно-мышечное соединение (при иммобилизации или денервации)
образование рецепторных компонентов усиливается (повышающая регуляция), и количество их на мембране миоцита возрастает. При высвобождении ацетилхолина рецепторы концентрируются и фиксируются на концевой пластинке. В процессах сборки и фиксации рецепторов участвуют несколько пептидов. Если высвобождение ацетилхолина увеличивается, число рецепторов уменьшается (понижающая регуляция). Понижающая и повышающая регуляция в клинических условиях приводят к развитию тахифилаксии и сенсибилизации к миорелаксантам .
2. Идеальный миорелаксант
Ни один из используемых в настоящее время миорелаксантов не соответствует критериям идеального миорелаксанта, предложенным Savarese и Kitz. Они выделили три вида релаксантов: имеющие быстрое начало и короткую продолжительность действия; промежуточного действия или длительного действия, препараты не должны иметь побочных эффектов и должны быть недеполяризующими 1 .
1 Вместо термина «миорелаксанты недеполяризующего действия» в настоящее время используют термин «миорелаксанты антидеполяризующего действия» (прим. научн. ред.)
Обнаружили, что начало действия миорелаксанта зависит от силы соединений, т.е. эффект менее мощных миорелаксантов развивается быстрее . Также были определены и другие требования к идеальному миорелаксанту: антидеполяризующий механизм действия, быстрое развитие эффекта, отсутствие кумулирования, побочных эффектов со стороны сердечно-сосудистой системы, высвобождения гистамина, быстрая и полная обратимость эффекта при использовании антихолинэстеразных препаратов, быстрая элиминация из организма вне зависимости от состояния функции почек и/или печени или биотрансформация в неактивные метаболиты . Миорелаксанты, повидимому, ответственны за 50% всех нежелательных реакций во время анестезии . Наиболее частыми побочными эффектами являются тахикардия, сердечно-сосудистый коллапс, крапивница и бронхоспазм. Такие реакции наиболее часто развиваются при использовании сукцинилхолина (суксаметония), реже - при использовании миорелаксантов бензилизохинолинового ряда и совсем редко - при применении стероидных миорелаксантов . Согласно результатам кожных проб, использование стероидных миорелаксантов практически не сопровождается выбросом гистамина . Наименьшая частота нежелательных эффектов отмечается при использовании пипекурония и векурония. Рокуроний может приводить к возникновению боли в месте введения и небольшим повышениям артериального давления и частоты сердечных сокращений. По сообщениям из Франции, Норвегии и Новой Зеландии, но не из других стран, при применении рокурония чаще развивались анафилактоидные реакции, чем при введении других миорелаксантов . Аллергические реакции развиваются при наличии в миорелаксантах замещённой аммониевой группы, ответственной за развитие аллергических реакций. Было доказано, что данный эффект отмечается при параллельном использовании лекарственных средств, содержащих фолкодин . Исследования показали, что фолкодин сенсибилизирует иммунную систему, приводя к повышению высвобождения IgE. Препарат свободно доступен в указанных странах, чем можно объяснить более высокую частоту анафилактоидных реакций на мышечные релаксанты, особенно на рокуроний, в этих странах.
3. Миорелаксанты
Используемые в настоящее время миорелаксанты воздействуют на никотиновые ацетилхолиновые рецепторы постсинаптической мембраны нервно-мышечного синапса. Некоторые соединения, преимущественно более старые, обладают ингибирующим влиянием и на другие ацетилхолиновые рецепторы, что приводит к развитию побочных эффектов. Применяемые в клинической практике миорелаксанты могут быть разделены на деполяризующие и антидеполяризующие, в соответствии с агонистическимм или антагонистическим действием на рецептор. В настоящее время единственным деполяризующим миорелаксантом, применяемым в клинической практике, является сукцинилхолин. Антидеполяризующие миорелаксанты могут быть разделены на следующие группы: соединения бензилизохинолинового ряда (d-тубокурарин, атракурий, цисатракурий, мивакурий, доксакурий) и стероидные релаксанты (панкуроний, пипекуроний, векуроний, рокуроний) . Кроме того, имеется ряд антидеполяризующих миорелаксантов с другой химической структурой (галламин, аллоферин), но их использование в клинической практике существенно ограничено. Нейромышечная блокада, обусловленная деполяризацией, характеризуется быстрым началом, появлением мышечных фасцикуляций (обусловленных их агонистическим эффектом) и отсутствием угасания эффекта при четырехразрядной стимуляции или тетанической стимуляции. При антидеполяризующей нейромышечной блокаде фасцикуляций не отмечается, однако имеется угасание ответа на четырехразрядную стимуляцию или тетаническую стимуляцию. Для уменьшения мышечной сократимости сукцинилхолин должен связаться с 25% рецепторов, в то время как для достижения аналогичного эффекта антидеполяризующих релаксантов необходимо их связывание с 70–75% рецепторов . Эффекты сукцинилхолина необратимы; тогда как нейромышечную блокаду, вызванную антидеполяризующими миорелаксантами, можно устранить с помощью ингибиторов ацетилхолинэстеразы (неостигмин, пиридостигмин, эдрофоний). Известно, что миорелаксанты бензилизохинолинового ряда, способны вызывать высвобождение гистамина, приводя к развитию бронхоспазма, гипотензии и тахикардии. В некоторых случаях при использовании любых миорелаксантов наблюдаются анафилактоидные реакции. Новые релаксанты бензилизохинолинового ряда метаболизируются в плазме крови путём реакции Гофмана и гидролиза эфирной группы, в значительной степени независимо от функции отдельных органов. Большинство стероидных миорелаксантов метаболизируются в печени и экскретируются с мочой, таким образом, их фармакодинамический профиль зависит от функции данных органов.
4. Сукцинилхолин (суксаметоний)
Сукцинилхолин был впервые внедрён в клиническую практику в 1951 г. . Быстрый метаболизм препарата псевдохолинэстеразой плазмы крови обеспечивает быстрое завершение нейромышечной блокады. Холинэстераза плазмы крови образуется в печени и присутствует в крови в большом количестве. Это обусловливает тот факт, что продолжительность действия сукцинилхолина увеличивается при тяжёлых заболеваниях печени. Из-за обычно короткой продолжительности действия сукцинилхолин преимущественно используют при эндотрахеальной интубации больного. Для обеспечения более длительных эффектов его можно вводить путём непрерывной инфузии, однако затем может развиваться так называемая II фаза блокады. Эта II фаза имеет характеристики антидеполяризующей нейромышечной блокады, может устраняться неостигмином и, наиболее вероятно, обусловлена десенситизацией ацетилхолиновых холинорецепторов .
Сукцинилхолин в большинстве случаев обеспечивает отличные условия для выполнения интубации. Большинство анестезиологов полагает, что продолжительность действия препарата составляет 5 мин. Однако хорошо известно, что длительность действия сукцинилхолина в стандартных для интубации дозах (1 мг/кг) составляет 10–15 мин и характеризуется значительной вариабельностью. Такая вариабельность зависит от активности холинэстеразы плазмы крови каждого пациента . Многие факторы влияют на вариабельность активности холинэстеразы плазмы:
- генетические нарушения, приводящие к снижению концентрации холинэстеразы или наличию атипичной холинэстеразы ;
- ингибирование активности холинэстеразы плазмы лекарственными средствами , в частности, метоклопрамидом , убретидом , эсмололом , экотиопатом , донепезилом , тербуталином и циклофосфамидом ;
- недостаточное питание или наличие соленоидов из картофеля ;
- плазмаферез , искусственное кровообращение и гемодиализ ;
- отравление фосфорорганическими соединениями ;
- длительное введение неостигмина или пиридостигмина ;
- массивная гемотрансфузия или переливание крови с её заменой ;
- ожоговая травма .
Сукцинилхолин имеет много побочных эффектов, таких как брадикардия, особенно при повторных введениях, мышечные фасцикуляции, миалгия, повышение внутриглазного, внутричерепного и внутрижелудочного давлений, а также высвобождение калия, приводящее к гиперкалиемии . Высвобождение калия может наблюдаться при повышающей регуляции ацетилхолиновых рецепторов, которая приводит к появлению во внесинаптическом пространстве фетальных типов рецепторов .
5. Каковы основные клинические проблемы при использовании антидеполяризующих миорелаксантов?
Антидеполяризующие миорелаксанты также обладают побочными эффектами . Известно, что препараты бензилизохинолинового ряда вызывают высвобождение гистамина, бронхоконстрикцию, гипотензию и тахикардию. В некоторых случаях наблюдаются анафилактоидные реакции. Общей проблемой при использовании всех релаксантов является значительная вариабельность их фармакодинамики. Фармакодинамический эффект антидеполяризующих миорелаксантов зависит от многих факторов:
- фармакологические характеристики миорелаксанта (длительного, промежуточного или короткого действия);
- b. сопутствующие патологии (печени, почек, воспалительных процессов, нарушений нервно-мышечной передачи) ;
- одновременно вводимые лекарственные средства (антибиотики, противоэпилептические препараты и т.д.) ;
- температура тела;
- кислотно-основной баланс (ацидоз, алкалоз) ;
- вид и глубина анестезии (ингаляционная, MAC) ;
- пол пациента ;
- возраста ;
- масса, телосложение пациента (влияют на объём распределения) ;
- гемодинамика пациента (медленное или быстрое кровообращение) .
Поскольку все эти факторы могут отличаться у отдельных пациентов, вариабельность эффекта миорелаксантов неудивительна . Вариабельность может выражаться в виде остаточного нейромышечного блока, который может вызвать послеоперационные осложнения со стороны дыхательной системы . Средняя частота послеоперационного остаточного блока составляет 40–50% , нередко несмотря на рутинное введение неостигмина . Нейромышечная проводимость полностью восстанавливается при значении TOF-отношения более 0,9, поскольку при более низких значениях нарушаются вентиляционный ответ на гипоксию, проходимость дыхательных путей и глотание . По результатам многих исследований можно заключить, что есть три важных фактора для профилактики остаточного блока : 1) использование только доступных миорелаксантов самого короткого действия; 2) рутинный объективный мониторинг нейромышечной передачи; 3) рутинное купирование нейромышечной блокады. По этой причине большинство анестезиологов в настоящее время применяют только миорелаксанты средней длительности действия (рокуроний, векуроний, атракурий, цисатракурий). Однако рутинный мониторинг используется на практике довольно редко , тогда как купирование нервно-мышечной блокады практикуется лишь в нескольких странах .
6. Рокурония бромид
Рокуроний представляет собой один из новых аминостероидных релаксантов с быстрым началом и промежуточной длительностью действия . Его значение ED90–95 составляет 0,3–0,4 мг/кг. После введения препарата в дозе, соответствующей удвоенному значению ED90–95, т.е. 0,9–1,0 мг/кг, возможна интубация трахеи при отличных условиях в течение 60–90 с . Рокуроний может вызывать незначительное повышение частоты сердечных сокращений и небольшое повышение артериального давления, предположительно из-за боли при инъекции препарата . Боли на инъекцию препарата чаще отмечаются у женщин, чем у мужчин . Показано, что эту боль можно предотвратить с помощью предварительного введения кетамина , дексмедетомидина , лидокаина , а также путём разведения препарата физиологическим раствором . Однако, по-видимому, также эффективны препараты магния, натрия карбонат, фентанил и алфентанил . Это свидетельствует о том, что боль обусловлена неспецифическим механизмом действия. Согласно нашему опыту, а также опыту коллег следует сделать заключение, что эта боль отмечается только при поверхностной анестезии. Боль не сопровождается другими последствиями, в частности, тромбофлебитом. Иногда имеются некоторые опасения, что рокуроний чаще вызывает анафилактоидные реакции, чем другие антидеполяризующие средства. Однако сообщения об аллергических и анафилактоидных реакциях после его введения поступали преимущественно из Франции, Норвегии и Австралии, но не из других стран . Это, возможно, связано со свободным использованием фолкодина, вызывающего сенситизацию иммунной системы у населения этих стран. После его изъятия из обращения в Норвегии констатировали, что частота анафилактоидных реакций на рокурония снизилось.
7. Устранение нейромышечной блокады
Обратимость эффекта является одним из основных требований к мышечной релаксации. До недавнего времени с этой целью в клинике использовали только антихолинэстеразные средства (неостигмин, пиридостигмин и эдрофоний). Ацетилхолинэстераза играет важную роль в процессах нервно-мышечной передачи путём элиминации молекул ацетилхолина из синаптической щели в результате их гидролиза. Лишь 50% молекул ацетилхолина, высвобождаемых из нервных окончаний, в итоге достигают постсинаптических рецепторов, остальные гидролизируются до этого. Хотя антихолинэстеразные средства также обладают прямым пресинаптическим действием, предполагают, что основным механизмом их действия является ингибирование ацетилхолинэстеразы. Пресинаптические эффекты приводят к учащению импульсации и повышению выброса ацетилхолина. Эти эффекты также способствуют устранению эффекта миорелаксантов. Стандартным средством для купирования нервномышечной блокады считают неостигмин. Начало действия препарата медленное, для полного устранения блокады требуется 10 мин или более, в зависимости от её выраженности и использованного средства . Проблемой при применении ингибиторов холинэстеразы является то, что их эффект зависит от вида и глубины анестезии. Более того, при глубокой анестезии не всегда удаётся купировать её неостигмином, что свидетельствует о связывании всех молекул холинэстеразы и отсутствии возможности дальнейшего связывания препарата с ферментом Помимо того, что ингибиторы ацетилхолинэстеразы увеличивают количество ацетилхолина в областях, соответствующих расположению всех видов рецепторов (никотиновых и мускариновых), они приводят к развитию таких побочных эффектов, как брадикардия, аритмия, гиперсекреции слюнных и бронхиальных желёз, а также повышение тонуса гладких мышц бронхов и кишечника. Побочные эффекты дозозависимы, более выражены при использовании неостигмина, менее выражены при использовании эдрофония . Лекарственные средства, за исключением эдрофония, также ингибируют антихолинэстеразную активность плазмы, таким образом удлиняя эффект сукцинилхолина . Снижение активности холинэстераз плазмы продолжается в течение 30–60 мин. При повторных введениях антихолинэстеразных средств может развиться временная деполяризация рецепторов, обусловленная транзиторной деполяризацией рецепторов и блокадой открытых кальциевых каналов .
Атропин и, в особенности гликопирролат, предупреждают многие сердечно-сосудистые эффекты антихолинэстеразных средств, но не способны предупредить влияния на желудочно-кишечный тракт . По крайней мере, неостигмин, как показано в одном исследовании, повышает частоту случаев тошноты и рвоты в ближайшем послеоперационном периоде . Аналогичный эффект был отмечен и другими авторами . В связи с наличием данных побочных эффектов в течение длительного времени не прекращается поиск идеального средства для устранения нервномышечной блокады. Сначала были изучены нескольких новых более чистых соединений с антихолинэстеразным эффектом, однако было доказано, что они обладают побочными эффектами, аналогичными таковым неостигмина . Позже разработали полностью новый метод устранения нервно-мышечной блокады с использованием молекулярной инкапсуляции . В итоге получили сугаммадекс (org 25969), модифицированный γ-циклодекстрин, обеспечивающий инкапсулирование молекул векурония и рокурония и таким образом инактивирующий их, который был отобран как потенциально идеальное средство для устранения нервно-мышечной блокады .
8. Каково идеальное средство для устранения нервно-мышечной блокады?
В процессе разработки новых лекарственных средств необходимо определить требования к ним. Это правило применимо также и к препаратам для устранения нервномышечной блокады. Такое лекарственное средство не должно обладать многими побочными эффектами ингибиторов холинэстеразы, поэтому, по мнению автора обзора, идеальное средство для устранения нервно-мышечной блокады должно удовлетворять следующим требованиям:
- обеспечивать полное устранение нервно-мышечной блокады в течение 1–3 мин;
- обеспечивать устранение нервномышечной блокады вне зависимости от степени её выраженности;
- не зависеть от вида и глубины анестезии;
- не зависеть от кислотно-основного состояния;
- обеспечивать устранение нервномышечной блокады при совместном использовании с другими лекарственными средствами (антибиотиками, препаратами магния и т.д.);
- не обладать побочными эффектами;
- обеспечивать устранение нервномышечной блокады у больных с заболеваниями различных органов (печени, почек);
- не обладать риском развития рекураризации;
- быстро экскретироваться из организма или не метаболизироваться в нём;
- не вызывать развития аллергических реакций;
- быть эффективным у пациентов, страдающих нарушениями нервномышечной передачи;
- обладать возможностью использования у пациентов всех возрастных групп;
- быть эффективным в отношении всех миорелаксантов;
- не обладать зависимостью эффекта от гипотермии.
9. Сугаммадекс
Сугаммадекс обеспечивает специфическое связывание (инкапсуляцию) стероидных миорелаксантов . Он не метаболизируется в организме, но как сугаммадекс, так и его комплекс с рокуронием быстро экскретируются с мочой . Время начала его действия зависит от дозы; полное устранение нервномышечной блокады любой степени выраженности достигается в течение 2–4 мин .
Однако он эффективен только при нервно-мышечной блокаде, вызванной стероидными миорелаксантами, но не в отношении миорелаксантов бензилизохинолиновой группы .
Препарат способен успешно устранять лёгкую, глубокую и выраженную блокаду, вызванную рокуронием и векуронием . Он также эффективен после повторных введений или непрерывной инфузии рокурония или векурония . В противоположность неостигмину действие сугаммадекса не зависит от вида и глубины анестезии , температуры тела и кислотно-основного состояния.
Поскольку механизм действия (инкапсулирование молекул рокурония и векурония) не связан с ацетилхолином, его рецепторами или другими рецепторами, вероятность нежелательных эффектов со стороны сердечно-сосудистой или дыхательной систем невелика . Сугаммадекс успешно вводили как пациентам пожилого возраста, так детям , больным с заболеваниями лёгких и сердечно-сосудистыми расстройствами . Также он был эффективен у больных с нарушением функции почек; рекураризацию при этом не наблюдали .
Если после введения сугаммадекса необходима повторная блокада, можно использовать нестероидные мышечные релаксанты или более высокие дозы рокурония . Восстановление нейромышечной проводимости после комбинированного введения рокурония и сугаммадекса происходит быстрее, чем после использования сукцинилхолина, в то время как обеспечиваются одинаковые условия для интубации . Сугаммадекс не инкапсулирует эндогенные вещества или другие лекарственные средства.
10. Может ли рокуроний заменить сукцинилхолин?
Применение сукцинилхолина имеет ряд недостатков. Как описано выше, сукцинилхолин обладает многими побочными эффектами, но также и отличным фармакодинамическим профилем (быстрое начало, короткую продолжительность действия, быстрое восстановление). По мнению автора обзора, из-за побочных эффектов и особенно из-за возможности развития гиперкалиемии его использование при интенсивной терапии устарело, и когда это возможно, данный препарат необходимо при анестезии заменять . Невозможно достичь приемлемых условий для интубации у всех пациентов при использовании сукцинилхолиния в стандартной дозе (0,5–1,0 мг/кг) . В связи с этим в настоящее время рекомендуется использовать дозы 1,0–1,5 мг/кг. Длительность действия сукцинилхолина варьирует в широких пределах вследствие значительной вариабельности активности холинэстераз плазмы. Хотя многие анестезиологи полагают, что длительность действия препарата в дозе, используемой при интубации (1–1,5 мг/кг), составляет только 5 мин, во многих случаях она превышает 10 мин. Это легко может привести к неприемлемой гипоксии. Benumoff et al. моделировали степень насыщения крови кислородом во время вызванного сукцинилхолином апноэ и получили весьма интересные результаты . Согласно их заключению: «...у подавляющего большинства пациентов на фоне апноэ, индуцированного введением сукцинилхолиния в дозе 1 мг/кг, отмечается угрожающее жизни снижение насыщения гемоглобина кислородом перед восстановлением функций». В исследовании, выполненном Heier et al., эти результаты подтвердились . Значительную десатурацию гемоглобина отмечали у трети пациентов в течение периода апноэ, индуцированного введением сукцинилхолина в дозе 1 мг/кг, несмотря на то, что в исследование были включены только молодые здоровые испытуемые. При этом степень десатурации коррелировала с продолжительностью апноэ. Особенно предрасположены к ранней гипоксии дети, поскольку они имеют меньшую функциональную остаточную ёмкость лёгких (ФОЭ) . Риск развития десатурации выше у пациентов с сопутствующими заболеваниями, нарушающими функции лёгких, поскольку их ФОЕ значительно ниже, чем у молодых здоровых субъектов . При родах и у пациентов с ожирением или сепсисом значительно ускорена артериальная десатурация, в то время как потребление кислорода у них выше . Известно, что во время апноэ скорость десатурации быстро увеличивается из-за снижения объёма альвеол, ведущего к коллапсу лёгкого, и нарастания вентиляторно-перфузионных нарушений, приводящих к шунтированию . У пациентов, страдающих ожирением, а также у беременных проведение преоксигенации в положении сидя замедляет десатурацию приблизительно на 1 мин . Однако этого может быть недостаточно для предупреждения гипоксии в связи со значительной вариабельностью эффекта сукцинилхолина. Более того, при значениях насыщения артериальной крови кислородом ниже 80% кривая динамики сатурации снижается гораздо быстрее даже при незначительных изменениях парциального давления кислорода в артериальной крови. Некоторые авторы предположили, что использование сукцинилхолина в более низких дозах повышает порог безопасности в отношении гипоксии из-за укорочения продолжительности апноэ, несмотря на обеспечение приемлемых условий для выполнения интубации . Однако в таких случаях ухудшаются условия для выполнения интубации, что удлиняет её продолжительность и повышает риск развития гипоксии. Недавно показано, что у пациентов, получавших сукцинилхолин в качестве блокатора нейромышечной передачи при интубации, гораздо быстрее развивается десатурация кислорода, чем у получавших рокуроний . Обнаружена связь между выраженностью фасцикуляций после введения сукцинилхолина и повышением экскреции CO 2 . Все эти факты показывают, что сукцинилхолин далёк от идеального миорелаксанта и не столь безопасен, как полагают большинство анестезиологов.
По этим причинам в течение долгого времени шёл поиск стероидных антидеполяризующих заменителей данного препарата. Однако не существует потенциальных лекарственных средств, не обладающих выраженными побочными эффектами . Препарат, заменяющий сукцинилхолин, должен обладать быстрым началом и короткой длительностью действия и обеспечивать отличные или хорошие условия для интубации. Рокуроний представляется препаратом, способным заменить сукцинилхолин благодаря быстрому началу действия, сходному с данным параметром у сукцинилхолина, и относительно благоприятному профилю безопасности. Однако при использовании в необходимых дозах рокуроний обладает значительно более длительным действием, чем сукцинилхолин. Из всех доступных в настоящее время антидеполяризующих релаксантов рокуроний имеет самое быстрое начало действия и обеспечивает отличные условия для выполнения интубации трахеи в течение 1–1,5 мин после введения, подобно сукцинилхолину . Это верно и для детей . Преимуществом рокурония перед сукцинилхолином является то, что он не вызывает брадикардии, а также не повышает внутриглазное и внутричерепное давления . Во многих учреждениях мира рокуроний вытеснил сукцинилхолин по причине большей безопасности при использовании для интубации трахеи. Единственным недостатком рокурония по сравнению с сукцинилхолином является большая продолжительность его действия. Доказано, что избирательный антагонист стероидных релаксантов сугаммадекс способен устранять индуцированную рокуронием блокаду любой степени выраженности в течение 2–3 мин при использовании в адекватных дозах . В противоположность неостигмину он устраняет нервно-мышечный блок независимо от вида и глубины анестезии . Сугаммадекс действует гораздо быстрее, чем неостигмин, и полное устранение нервно-мышечной блокады отмечается уже через нескольких минут после его введения . Это может обеспечить необходимую длительность действия рокурония при интубации трахеи. В высоких дозах начало действия рокурония приближается к аналогичному параметру сукцинилхолина, а устранение блока, вызванного рокуронием, с помощью сугаммадекса, достигается быстрее по сравнению со спонтанным восстановлением нейромышечной проводимости после сукцинилхолина, что было подтверждено у больных, и в настоящее время ожидаются результаты дальнейших исследований в этом направлении . В результате комбинация рокурония и сугаммадекса обеспечивает возможность нового подхода к управлению нервно-мышечным блоком, позволяющего вытеснить сукцинилхолин из клинической практики. Комбинация рокурония и сугаммадекса действительно имеет клиническое значение . Возможен не только старый слоган: «Прощай, Сукцинилхолин!», но также и «Прощай, Неостигмин!» при условии, что сугаммадекс зарекомендует себя при использовании в клинической практике . Однако в настоящее время представляется вероятным, что сукцинилхолин будет вытеснен даже из перечня оставшихся показаний.
11. Заключение
Остаточный блок представляет собой реальную проблему послеоперационного периода и вносит свой вклад в инвалидизацию и летальность, связанные с анестезией. Введение неостигмина, помимо риска многочисленных побочных эффектов, не гарантирует предупреждение такого остаточного блока. Сугаммадекс в настоящее время представляется наиболее идеальным средством для устранения остаточной нервно-мышечной блокады и может предупреждать остаточный блок во всех ситуациях. В комбинации с рокуронием он является возможной альтернативой сукцинилхолину.
Последние материалы сайта
Медицина

Православный взгляд на йогу
ВОСТОЧНЫЕ ПРАКТИКИ ДЛЯ ЖЕНЩИН. ОЧЕНЬ МНОГО ПОЛЕЗНОГО Практика «Драгоценная лодка Небесного Дракона»Данная практика позволяет убрать сеточку лопнувших сосудов на ногах. Предотвратить появляющиеся с возрастом вены на руках и ногах. Улучшить кровообращение в
Худеем вместе

Как чистить рыбу Надо ли вырезать жабры когда варишь уху
Данная статья посвящена чистке речной рыбы (в общем-то схема чистки одинакова для всей рыбы водящейся в пресноводных водоемах России). Освоив методику на часто встречающемся в средней полосе России карасе, окуне, щуке, плотве и леще опыт можно легко распр
Разное

Названия спортивных упражнений на английском
Это отличный способ побороть свои страхи. Всерьез занявшись бейсджампингом, вы точно избавитесь от страха самолетов, а после скоростного спуска на любые американские горки покажутся вам аттракционом. Занятия экстремальными видами спорта прибавляют уверенн
Упражнения

Как подобрать теннисную ракетку
Стиль и качество игры теннисиста зависят от множества факторов, основной из них - выбор ракетки. Несмотря на совершенство техники, без хорошего инвентаря невозможно удачно сыграть. Чтобы правильно подобрать его, нужно разобраться во многих нюансах, в том
Видео

Захаркин, игорь владимирович
В четверг сообщил агентству "Р-Спорт", что . Ниже приводится биографическая справка о тренере. Игорь Владимирович Захаркин родился 16 марта 1958 года в Брянске. Хоккеем начал заниматься в городе Конаково, а потом перешел в ЦСКА, хоккейную школу которого
Полезно знать
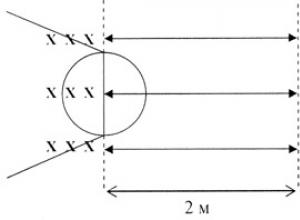
Если хочется играть, но нет опыта: основы баскетбола для начинающих
В профессиональном так и любительском спорте баскетболисты проводят тренировки под руководством и наблюдением тренеров команды. Но ко всему этому, чтобы добиться высоких результатов, спортсмен должен уметь тренироваться и самостоятельно. В профессиональн